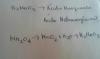-
Queremos preparar 10 dm^3 de ácido sulfúrico 3 M a partir de sulfúrico del 92.77% y densidad 1.827 g/cm^3. ¿Que volumen de este se habrá de utilizar?


José Miguel
el 31/10/16Hola Miriam, lo primero es que hubiese estado bien que nos mandases algo hecho, para ver dónde cogeas, es la mejor manera de ayudaros. Después del briconsejo... jajaja
Lo primero es calcular la cantidad de sulfúrico que tenemos inicialmente, así que como referencia tomamos 1 litro, el cual con la densidad indicada tendrá una masa de 1827g y de esos gramos, el 92,77% es sulfúrico puro, por lo que tendremos 1694,9gramos de sulfúrico puro.
Lo siguiente es calcular la cantidad necesaria para preparar una disolución de 10dm3, lo que equivale a 1 litro (si no controlas mucho eso, mírate las tablas de equivalencia), así que mediante la fórmula de la molaridad: molaridad (M)=moles de soluto/volumen de disolución(L) así que 3M=moles de soluto/1L; despejando nos queda que se necesitan 3 moles de ác. sulfúrico, que traducido a masa son 294g (ya que la masa molecular es 98g/mol).
Bien, sabiendo la cantidad requerida, si 1694,9 gramos de sulfúrico están contenidos en 1 litro de disolución principal, 294 gramos estarán contenidos en... Después de hacer una sencilla regla de tres, obtenemos 0,173 litros serán de disolución principal, y el resto de volumen hasta completar 1 litro, será agua para diluir, de modo que terminamos teniendo nuestra disolución requerida por medio de una dilución de un ácido más concentrado.
Espero haberte ayudado.
Saludos.
-
-
Hola Unicoos, me podrían explicar la diferencia entre síntesis e hidrólisis? No tengo muy claros los conceptos, cuando se forma un enlace se libera agua y por lo tanto se produce la síntesis?
Aquí os envío la explicación de mi libro.


José Miguel
el 31/10/16Hola, es correcto, normalmente los enlaces entre biomoléculas suelen ir asociados a la pérdida de una molécula de agua, como el enlace peptídico entre aminoácidos, o el enlace o-glucosídico entre los monosacáridos.
La síntesis en este caso se refiere a la formación de una macromolécula (polímeros) a partir de moléculas más pequeñas (monómeros); la hidrólisis sería el paso contrario, degradar esas moléculas para obtener sus unidades estructurales. Aunque no te dejes guiar por el término hidrólisis, quédate con el sufijo "lisis" que significa ruptura, porque por ejemplo, en el caso de la degradación del glucógeno a glucosa-6-P, el proceso se denomina glucogenólisis.
Espero haber aclarado tu duda.
Saludos.
-
Hola unicoos,
una pregunta tonta; es lo mismo escribir OH que O-H ? por ejemplo en el grupo hidroxilo
Muchas gracias
-
Conocéis algún canal de youtube que enseñe física de universidad para ingeniería?


José Miguel
el 30/10/16Hola Elide, te recomiendo el canal de youtube Professor.ingeniero
El enlace es el siguiente: https://www.youtube.com/channel/UCt-zrVdqXmDRwo2CxrwTadA
Saludos.
-
Hoola una pregunta solo a los oxoacidos del grupo 15 se les añaden los prefijos orto piro y meta en la nomenclatura tradicional?
-
Hola unicoos! Necesito ayuda con este ejercicio ya que no consigo saber como hallar las presiones en el equilibrio partiendo de las presiones iniciales... Gracias!



David
el 31/10/16A partir de Kc, puedes deducir Kp pues Kp=Kc.(R.T)^(An)... Como en nuestro caso An=2-1-1=0... Kp=Kc...
Inicialmente PN2=0,5 = XN2. P = (nN2 / n). P., siendo "n" los moles totales iniciales y P la presion total de la mezcla.
La presion total es la suma de las presiones parciales, por tanto P=0,5+0,5=1 atm.... 0,5= nN2 / n.... 0,5.n=nN2... .n=2 . nN2 Del mismo modo n=2. nO2Partimos por tanto de la misma cantidad de moles de cada reactivo, que llamaremos "no".
N2..... +.....O2 = 2NO
no ........ no
no-x..........no-x 2no...
Los moles totales serán 2no+no-x+no-x=4no-2x... Por otra lado...Kc=2,5.10^(-3) = (2no/V)² / (((no-x)/v)(no-x)/v))) = 4no² / (no-x)²
A partir de ahí, no sabría que decirte, pues sinceramente el ejercicio me "pierde". Tengo la sospecha de que falta algun dato... -
Hola buenos días a todos , alguien me puede ayudar con el siguiente problema Solo quiero saber como puedo sacar los gramos de cada gas? Muchas gracias .
Saludos


David
el 31/10/16Los moles de CO2 son 1,45/44=0.033 moles de CO2. El % en volumen es igual a la fraccion molar de cada gas...
Tomando el CO2 y su porcentaje en volumen, 0,033/n = 0,4... n=0,0825 moles. Esos son los moles totales.
Aplicando P.V=n.R.T con la totalidad... P.2= 0,0825.0,082.293... P=0,991 atm, esa es la presion total...
La presion parcial de N2 será PN2=XN2. P = 0,38. 0,991=0,3766 atm
La presion parcial de O2 será PO2=XO2.P=0,22.0,991=0,218 atm
Echale un vistazo... Presion parcial de un gas