-
Buenas tardes, David Calle, ¿cual es la direccion exacta de la academia?


Breaking Vlad
el 26/11/18Hola Álvaro,
Sentimos comunicarte queya no quedan plazas, sin embargo puedes encontrar toda la información en www.unicoos.com/nosvemosenclase
Un saludo,
Breaking Vlad
-
Hola les agradecería si me ayudan con este ejercicio:
Balancea la siguiente ecuacion , utilizando el método de ion- electrón:
HCIO4 + HI + K2CrO7➡ Cr (CIO4)3 + l2 + KCIO4 . H2O


Jerónimo
el 22/11/18HCIO4 + HI + K2Cr2O7➡ Cr (CIO4)3 + l2 + KCIO4 . H2O
3 x (2I- -----------------------I2 + 2e)
Cr2O7-2 + 14H+ 6e ----------2Cr+3 +7H20
-------------------------------------------------------------
6I- + Cr2O7-2+ 14H+ ------3I2 + 2Cr+3 + 7H2O
8HCIO4 + 6HI + 1K2CrO7➡ 2Cr (CIO4)3 + 3l2 + 2KCIO4 + 7H2O
-
Hola buen día, me dirían como calcular el ph de una solucion 0.05M de h2SO4. Se los agradecería muchísimo
-
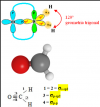
Hola ! Alguien me podría ayudar con el diagrama de lewis del metanal ?Gracias de antemano!


Jerónimo
el 22/11/18HCHO
e- totales 2x8+2x2=20
e- valencia 4+2x1+6=12 (6 pares en total) (20-12)/2=4 pares compartidos
El átomo de carbono tiene hibridación sp2 formando 3 orbitales híbridos sp2 y quedando 1 orbital p puro.
Los orbitales híbridos forma 3 enlaces sigma y el orbital p puro forma un enlace pi (hay un error en la foto que pongo)


Breaking Vlad
el 22/11/18Hola Pilar,
aunque técnicamente la respuesta de Jerónimo es correcta, el diagrama de Lewis del metanal es el siguiente:
ahí se muestra como se enlazan los electrones para completar los octetes, la respuesta de Jerónimo está más basada en la teoría de orbitales moleculares. Es algo más avanzado.
Si tienes más dudas, te recomiendo este vídeo: Estructura de Lewis y Regla del Octeto
Un saludo,
Breaking Vlad
-
Hola buenas tardes desde Uruguay. Tengo una duda respecto a concentración de soluciones. Si tengo 40 g/l de Nacl , serían 40 g de Cloruro de sodio disuelto en agua y luego hay que agregarle AGUA hasta llegar a 1 litro?Gracias.
-
Hola a todos, me gustaría saber si alguien podría explicarme cómo hacer el siguiente ejercicio:
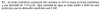
¡Muchas gracias de antemano!


Jerónimo
el 21/11/18Disoluciones 01 Disoluciones 02
1,19g/ml x 20ml x 37g/100g x 1mol/36,5g =0,241 moles
En 20 ml del ácido comercial habrá 0,241 moles de HCL
Para que sea 0,1 mol/l M=n/V 0,1=0,241/V V=2,41 l de disolución 2410-20= 2390 ml de agua
-


Jerónimo
el 21/11/18La respuesta es correcta pero tienes que explicar el porquë .
Si calculas el pH considerando sólo los protones aportados por el HCl y después calculas el pH considerando ambos (H+ aportados por HCl y H+ aportados por el agua, en ambos casos te da un pH de 6,04, por lo que se puede despreciar.
-
Primero saque los moles de cada compuesto que tengo:
0.025 L solucion HCl* 0.11 moles HCl/1L solucion HCl = 0.0025 mol HCl
0.025 L solucion AgNO3*0.15 mol AgNO3/1 L solucion AgNO3 = 0.00375 molLuego tranformo los gramo que tengo de AgCl:
0,349g AgCl *1 mol AgCl/143.45 g AgCl = 0.00243 mol AgCl
Pero luego no se como hallar la concentración que me piden pues cuando hago la relación entre Hcl y AgCl me da que los moles consumidos de Hcl son 0.00243 y no 0.0025. Nesecito ayuda.


Jerónimo
el 21/11/18HCl+AgNO3------→AgCl+ HNO3
Lo que has hecho es correcto, Al calcular los moles de AgNO3 vemos que ese reactivo está en exceso , pues al reaccionar 1 mol de AgNO3 debe producir 1 mol de AgCl. El que limita la reacción es el HCl. Si se ha obtenido 0.00243 mol AgCl es porque disponiamos de esos mismos moles de HCl (pues por la estequiometría de la reacción, tambies es 1 a 1).
Sólo queda sacar la M del HCl M= moles /V en litros = 0.00243 mol/0,025= 0,0972 M
Este resultado indica que en el laboratorio no se ha preparado correctamente la diolución que deberia ser 0,1 M y ha salido un valor menor ( 0,0972 M)