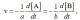-
Buen día, en CINÉTICA QUÍMICA podrían ayudarme con el siguiente ejercicio?
La constante de velocidad de una reacción se triplica cuando la temperatura aumenta de 298K a 308K. Encuentra le energía de activación (Ea).David
el 23/5/16Echale un vistazo. Tienes uno identico... Cinética Química
Antonio Grexis
el 27/5/16Partimos de la ecuacion de Arrhenius: k = Ae^-Ea/RT
Aplicando propiedades de los logaritmos:
Ink1 = lnA - Ea/RT 1 tomamos k2= 3k1 y T2= T1 + 10
In3k1= InA - Ea/RT2
restamos las ecuaciones y despejamos Ea , termina de hacerlo tu puedes , en el proceso In A se cancela en ambas ecuaciones -
Me podrían ayudar a hacerlo? No se si contar los productos o productos y reactantes :(
0,490 moles contenidos en 56,0 g de un aminoácido formado por C,H,N y O se queman con exceso de O2(g) en un reactor de 74,1L , generándose CO2 (g), H2O (g) y NO2(g). Las presiones ejercidas por cada fas medidas a 50°C son 0,7053 atm, 0,5268 atm y 0,3509 atm respectivamente. Determine
• La presión total del sistema
• Las fracciones molares de cada gas
• La densidad de H2O en g/L
David
el 23/5/16Echale un vistazo y nos cuentas ¿ok?... Presion parcial de un gas
-
Hola! Me he quedado atascada en este ejercicio.
La reacción en fase gaseosa A + B --> C + D es endotérmica y su ecuación cinética es: v = k[A]2
Tengo que justificar si la siguiente afirmación es verdadera o falsa:
a) El reactivo A se consume más deprisa que el B. -
El radio orbital es lo mismo que el radio de un planeta?
En que se diferencian?sara
el 22/5/16El radio orbital es la distancia de radio desde el planeta hasta el centro que órbita (ejemplo desde la Tierra hasta el sol) y el radio de un planeta es la distancia desde la corteza terrestre hasta el núcleo de ese mismo planeta. (ejemplo corteza terrestre hasta centro de la Tierra)
-
Hola, me ayudan con este ejercicio de gases ?
El numero de atomos de azufre presentes en un volumen de 0.045L de SO3 medidos a 550 torr y 120°Cpablo
el 21/5/16Tenes que pasar todas los torr a atmosferas y los grados a kelvin , luego despejas los números de moles a partir de la formula P.V=nRT.
Después haces la regla de 3 que involucra a los moles y moléculas para despejar las moléculas que tenes y por ultimo haces la regla de 3 que dice en una molécula tengo 1 atomo de S y con las moléculas halladas en el paso anterior despejas los átomos de azufre.
-
hola, mi duda es: ¿como saber cuando un acido o una base es fuerte o debil?
muchas gracias.David Moldes
el 21/5/16Mirando si tiene o no constante de acidez. Si no la tiene, querrá decir que como es tan alta, el eq va a estar desplazado todo hacia la derecha. En cambio, si tiene cte, quiere decir que sólo una parte del ácido se convierte en la base conjugada respectiva y en hidronios.
Si profundizas un poco, también se habla de ác moderadamente fuertes, débiles y muy débiles, y para distinguir unos de otros debes atender a sus pKa (todos estos matices de ácidos entrarían dentro de tu clasificación de "débiles"). -
Hola,
Es un ejercicio que pertenece al tema de química orgánica, dejo el enunciado a continuación y mi procedimiento en la imagen.
Por si no se lee: Para neutralizar 25cl de vinagre se necesitaron 40cl de disolución de NaOH 0,5M ¿Qué masa tenemos de ácido en 1L?
Mi duda es que al aplicar la fórmula, M= mol de soluto/ litros disolución, no sé si tengo que hacer la suma de los dos líquidos, NaOH y vinagre, para obtener los litros totales de la disolución (denominador en la fórmula).
Lo he hecho de las dos maneras:
- sin la suma, en boli. Esa era la primera manera que intenté.
-con la suma, en lápiz. Solo he ido poniendo resultados porque el procedimiento estaba hecho con la otra manera.
¿Cuál estaría bien de los dos?
Gracias!
David
el 23/5/16El vninagre es acido acetico.. Y se hace como en este video... Hidrolisis - Valoracion ACIDO debil BASE fuerte
-
Hola,
Tengo unos ejercicios de isomería y quería comprobar que estuviesen bien resueltos o que existan.
a) Isómeros de cadena del hexanol.
b) isomeros de posición y función del propanoato de etilo.
Dejo en la imagen mis ejemplos excepto para el isomero de posición del propanoato de etilo porque no se me ocurre ninguno.
Gracias!David
el 23/5/16 -
Hola me gustaría que alguien me dijese en que vídeo puedo encontrar la solución a este problema, no pido el resultado, tan sólo sólo el vídeo para poder entender cómo se hacen este tipo de problemas. Gracias
La ecuación termoquímica para la combustión del etileno gaseoso es la siguiente:
CH2=CH2 (g) + O2 (g) --> CO2 (g) + H2O (l)
▲Hcº = -1408,66 KJ/mol a 25ºC y 1atm
Suponiendo que el rendimiento es del 75%, ¿cuántos kg de agua a 20º pueden alcanzar la temperatura de 100ºC cuando se queman 100L de etileno?
David
el 21/5/16Pasa los 100 litros de etileno a moles...
Como por cada mol de etileno se desprenden 1408,66KJ podrás obtener los KJ que se desprenden para los moles obtenidos.
Aplica el 75% al valor obtenido pues el rendimiento es del 75%... Ese es el calor Q que permitirá calentar el agua
A partir de ahí, calorimetria.. Q=m.Ce.(tf-to).. Q(KJ)= m. 4,18 KJ/KgºC. (100-20)... Te vendrán bien...
Termodinámica y Equilibrio térmico -
Hola David.
Antes de nada darte las gracias por el gran trabajo que haces. Me has servido de ayuda en más de una ocasión.
Me gustaría dejar la propuesta de que hicieras vídeos nivel universitario de Química, ya que es la carrera que estudio.
Un saludo.