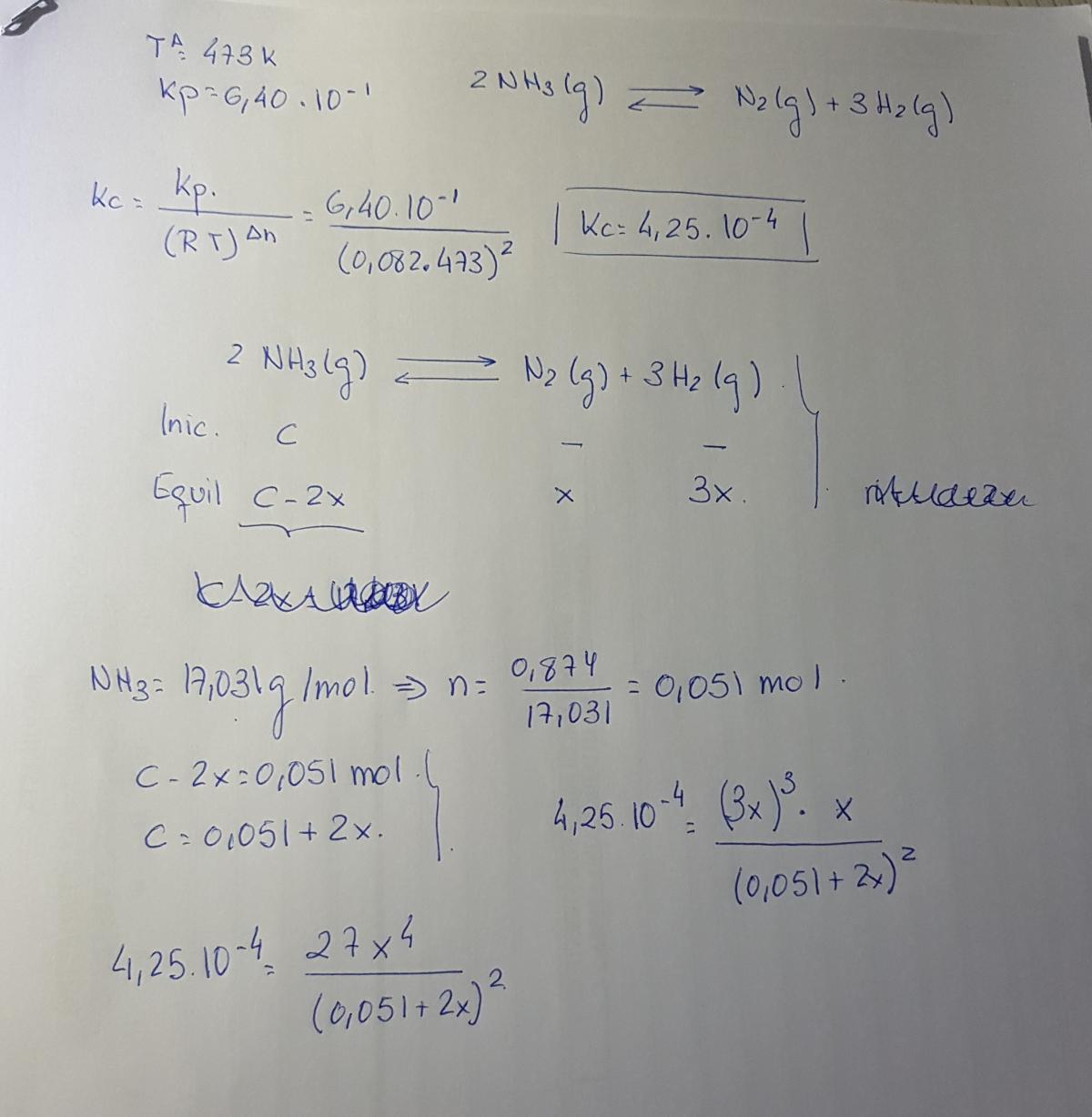-
Buenas. Necesito ayuda con este:
La fórmula empírica de un compuesto orgánico es C2H4O y que al vaporizar 0'503gr de esta sustancia ocupa 610ML medidos a 229mm de Hg y 120ºC. Calcula su forma molecular.


Jerónimo
el 14/11/18Fórmula empírica y composición centesimal
C2H4O Mm de la F empírica=44
Aplicando PV=g/Mm RT Mm de la Fmolecular=(gRT)/PV = (0,503x0,082x393)/(0,3013x0,61)=88g/mol n=2 C4H8O2
-


Breaking Vlad
el 13/11/18Hola Carmela,
la Kp que te dan es la de la reaccion N2 + 3H2 <-> 2NH3
Y al hacer el cálculo de Kc has calculado Δn al revés. Has hecho 1+3-2 mientras tendría que ser 2-1-3
Al igual que en el apartado de abajo has utilizado la Kc calculada para la reacción inversa. Lo cual no es correcto.
Un saludo,
Breaking Vlad
-
Buenas tardes. De este ejercicio, solo tengo una duda del enunciado. He intentado hacer y rehacer la estructura de Lewis del NH4- pero es imposible... la carga formal siempre será +1 porque el nitrógeno no puede expandir octete (y por ello no puedo añadirle un par de electrones no enlazantes. ¿Cómo se haría?
-
Hola ! Quisiera ayuda para poder resolver estos dos problemas:
1) La potencia frigorífica de una bomba de calor es de 20kW y su eficiencia frigorífica es 4. Calcular la potencia térmica (potencia térmica que recibe el condensador de la bomba). (En este creo que sería dividir la potencia frigorífica entre su eficiencia suponiendo condiciones normales dando como potencia 5KW pero no sé si estoy en lo correcto).
2) Cual es la diferencia, en presión y potencia, entre una turbina de vapor de condensación y otra sin condensación con el mismo caudal de vapor, presión y T entrada.
Agradeceré su ayuda!
-
Buenas, en verdadero o falso, que dirían de esta: la afinidad electrónica de un catión es mayor que la del átomo correspondiente ?
muchas gracias por la ayuda :)


Jerónimo
el 11/11/18La afinidad electrónica se define como la energía involucrada cuando un átomo gaseoso neutro en su estado fundamental captura un electrón y forma un anión
Si al ganar un electrón se desprende energía, la afinidad electrónica es positiva, y el ion formado es estable.
Si por el contrario se absorbe energía, la afinidad electrónica es negativa y el ion formado es inestable.
Los elementos con alta energía de ionización tendrán gran tendencia a ganar electrones : tendrán afinidades electrónicas positivas.
Los elementos con baja energía de ionización tendrán poca tendencia a ganar electrones : tendrán afinidades electrónicas negativas.Por tanto , la AE de un catión es mayor que la del átomo correspondiente.