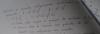-
¿Como hacer con el error absoluto y el error relativo, la media de dichos datos?. Gracias.


Jerónimo
el 21/10/18Lo normal es que te den los datos , calcules el valor medio (valor verdadero) y a partir de ahí el error absoluto y el error relativo.
Pero a partir de la fórmula que relaciona el Eabsoluto y el E relativo puedes calcular el valor considerado como bueno (media de datos)
Erelativo= Ebsoluto/valor real x100
-


Jerónimo
el 21/10/18Ley de Gay-Lussac o de los volúmenes de combinación
Ley de combinación de volúmenes e hipótesis de Avogadro. Según la ley de combinación de volúmenes de Gay-Lussac los volúmenes de gases de distintas sustancias consumidas al reaccionar, en las mismas condiciones de presión y temperatura, estaban en proporción de números enteros.
N2+3H2-----------→ 2NH3
-
Hola ,¿ como se haría este problema? gracias . El cobre natural está formado por los isótopos Cu-63 y Cu-65. El más abundante es el primero, con una distribución isotópica de 64,4 %. Calcula la masa atómica aproximada del cobre.
-
-
Buenas, la bascula en la que nos pesamos, que está midiendo realmente nuestro peso o nuestra masa???


Jerónimo
el 20/10/18Esta duda debes postearla en el foro de física pero voy a intentar aclarar tu duda.
Lo que mide una balanza es el peso de un cuerpo, cuando decimos que un objeto tiene una masa de 5 kg, eso es incorrecto, lo que realmente deberíamos decir es que tiene un peso de 5 Kilogramos fuerza (kilopondios) que equivale a 5x 9,8= 49 N
1Kp= 9,8 N
-


Breaking Vlad
el 19/10/18Te sugiero este video..
Enlace covalente Estructura de LEWIS
A partir de ahí, se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)