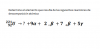-


Breaking Vlad
el 15/10/18Hola Carmen,
vamos por partes, estas son tus erratas:
2. Etanamida (y si fuera un carbono sería metanamida, no metamida)
4. es propanAL no propanOL
7. dimetilamina
8. mal, es un benceno con un OH en un lado y en posición 3 un etilo.
11. es 1,3
12. Etanoato de metilo
14. difenilamina
16. es un benceno, no un ciclohexano, faltan los dobles enlaces
17. está bien, pero entre el primer CH y el (CH3)2, no hay guión. CH(CH3)2
18. Este sí lo tienes bien, mientras que el 4 lo hiciste mal... Esos despistes...
19. 1,3,5-HexaNOtriol
21. te falta poner el CO de la cetona. Eso es un alcano
22. va un COOH en cada extremo
24. Aquí es un triple enlace, no uno doble.
Toca repasar un poquito más. Mucho ánimo y sigue practicando!
Un saludo,
Breaking Vlad
-
Alguien me puede ayudar con estos dos ejercicios ?¿
Ejercicio 1 :
la Atmósfera tiene aproximadamente un 21% en masa de Oxigeno, un 78% de nitrógeno y un 1% de Ar. ¿ Cual es la fracción molar y la presión de cada gas a presión atmosférica?
Con tan pocos datos como puedo resolverlo ?¿
Ejercicio 2 :
6.76g de un gas ocupa un volumen de dos litros a 680 mm de HG y 40 grados .Sabiendo que la composición centesimal es de 73.20% de Cl, 24,74% de C y 2.06% de Hidrógeno ¿ Calcula la fracción molar y la presión parcial de cada gas a presión atmosférica.
Mi duda : Sabemos que el Cl es diatomico, el Hidrógeno también pero el Carbono no , pero si ajustamos la formula se queda C2H2CL2 . Entonces para calcular los moles de cada elemento ,¿ Uso la formula ajustada ? Por ejemplo para el Carbono,¿Debería usar C o C2? Me explico mi duda?
Gracias por su ayuda
-
Buenos días.
¿En un compuesto como el Al2O3 es obligatorio nombrarlo por nomenclatura sistemática como trióxido de dialuminio o vale también como óxido de aluminio por no haber ambigüedad al solo haber un estado de oxidación para el aluminio?
Gracias de antemano.
-
Hola, necesitaria que alguien me explicara dónde está el error en este ejercicio, ya que estoy tratando de encontrarlo y no puedo. Los valores despejando x me dan negativos, cosa que no puede ser. Los resultados del ejercicio son [N2O4] = 0,01864 mol/L ; [NO2] = 0,06272 mol/L. Muchas gracias
-
Hola buenas, alguien sabe como realizar el siguiente ejercicio?, no se como abordarlo y estoy algo confundido, desde ya muchas gracias


Breaking Vlad
el 15/10/18Se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)

Juan
el 15/10/18Hola buenas, gracias por tu respuesta, normalmente repaso las materias cuando salgo de clases, pero lo que pasa es que mi profesor nos envió un trabajo y entre ellos estaba ese ejercicio, el cual no enseño como se debía realizar(cosa que no tienen por que saber, ya que no viene al caso). Creí que aquí en el foro al menos podrían darme un guía, de como hacerlo, ya que como dije, el profesor no enseño como hacerlo, y por eso no puedo realizar un duda concreta... Se que no me harán el ejercicio, claro es mi trabajo, pero al menos una pista de como abordarlo, por algo es un foro, si supiera hacer el ejercicio, no entraría en busca de ayuda. Saludos
-
https://www.unicoos.com/video/quimica/1-bachiller/estequiometria/estequiometria/quimica-riqueza-o-tanto-por-ciento-en-masa
Alguien sabe porque en el video no se ajusta la primera reacción?? es decir no nos deberían haber dado la reacción completa ajustar y después encargarse solo del caco3 como hace en el video?? Saludos :P
-
Me podéis echar una mano con este ejercicio de energías de enlace: Utilizando la información siguiente, determine la energía de enlace entre los átomos de carbono en el acetileno: a) Entalpía de formación del acetileno es DH = 54,2 kcal; b) entalpía de sublimación del grafito es DH = 171, kcal; c) entalpía de disociación de H2 es DH = 104,2 kcal; d) entalpía de formación de metano es DH = -398 kcal.
-
6. Calcular la molaridad de una solución al 5 % P/V de glucosa. Dato: PM=180 g/mol
-


Breaking Vlad
el 15/10/18Te sugiero este video..
Ley de Hess | Termodinámica
A partir de ahí, se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)