-
Buenas tardes, no puedo hacer este ejercicio, por que me dan la presión total en cada tiempo, me enseñaron este tipo de ejercicios con moralidad y tiempo, he aplicado la misma formula de moralidad con las presiones pero no me sale el resultado. Tal vez haya otra forma de hacerlo con presiones quisiera que me ayudaran por favor.
Gracias
-


Breaking Vlad
el 6/2/18Se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)
-
hola...en el siguiente ejercicio use esta formula
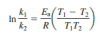 para primero hallar la energia de activacion y con esa energia hallar la constante a 400K. Para hallar esa constante reemplace k1=5*10^-2 y T1=300 pero no me sale el resultado. Me podriadecir si hay ptra forma de hacerlo?
para primero hallar la energia de activacion y con esa energia hallar la constante a 400K. Para hallar esa constante reemplace k1=5*10^-2 y T1=300 pero no me sale el resultado. Me podriadecir si hay ptra forma de hacerlo?

Breaking Vlad
el 6/2/18Hola Nicole,
ese ejercicio se haría representando la ecuación de Arrhenius linealizada, y calculando a partir de ahí: A y Ea.
Luego con esos datos sustituyes en:
k = A· e^(-Ea/RT)
y lo tienes.
Aquí tienes un vídeo donde habla David de ello
Ecuación linealizada de Arrhenius
Un saludo,
Breaking Vlad
-
¿Es correcto decir que cuando una molécula diatómica pierde un electrón, la energía de enlace siempre disminuye; es decir, que el enlace se hace más débil? Explíquelo


Breaking Vlad
el 5/2/18Se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)
-
BUENAS TARDES, QUERÍA SABER SI TIENEN ALGUNA ACTIVIDAD DOBRE LA SEPARACIÓN DE MEZCLAS HOMOGÉNEAS, HETEROGÉNEAS Y DE LAS DOS.
GRACIAS Y ESPERO SU RESPUESTA.
-
Buenas tardes.
Se podría calcular la energía libre de Gibbs de una reacción a partir de las energías libres de formación de los productos menos las energías libres de formación de los reactivos como se hace con la entalpía o no es posible.



















