-
Hola podeis ayudarme?
- Al añadir agua al carburo de calcio, CaC2, se produce hidróxido de calcio y C2H2 (acetileno), que es un gas.
- Escribe y ajusta la reacción química que tiene lugar. (0,4 puntos)
- Calcula la masa de carburo de calcio que se necesita para obtener 4,1 L de acetileno, medidos a 27ºC y 1760 mm Hg. (0,8 puntos)
- Calcula la masa de agua que se necesita si lo mezclamos con 50 g de CaC2. (0,8 puntos)
-
Hola, tengo unas dudillas con 3 problemas:
1°Se desean obtener 45g de cloruro de cinc haciendo reaccionar en exceso de sulfuro de cinc con la cantidad suficiente de ácido clorhídrico:
a)¿Qué cantidad de ácido clorhídrico del 30% se consumirá?
b)¿Qué volumen de sulfuro de dihidrógeno obtendremos en CN?
2°Al calentar 13,4g de NH4.HCO3 impuro se obtienen además de amoniaco y agua, 3,4litros de CO2 medido en CN. Halla la pureza de NH4.HCO3.
3°Al reaccionar 500g de nitrato de plomo (II) con 920g de yoduro de potasio se obtienen 600g de yoduro de plomo (II), así como nitrato de potasio. Determina el rendimiento de la reacción y establece cuál de los reactivos está en exceso.
Es urgente!! Por favor


Breaking Vlad
el 20/11/17Te sugiero este video..
Estequiometria 02
A partir de ahí, se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)
-
Hola.
Las dudas están en la imagen, rodeadas de rojo. Espero me las podáis resolver.
Muchísimas gracias por lo que hacéis.
Un saludo :)


Breaking Vlad
el 20/11/17Hola Sergio, lo que dice Jerónimo es cierto, sin embargo, déjame explicarte porqué se ponen enteras las moléculas orgánicas.
1. Porque están formadas por enlaces covalentes que no se disocian en disolución
2. Porque dentro de los compuestos orgánicos los distintos carbonos pueden tener distintos estados de oxidación, y eso hace que no puedas "separar" arbitrariamente todos los carbonos.
Y en cuanto a lo del Cromo, tal y como dice él, en el Cr2(SO4)3 tienes 2 iones Cr2+ que disocian en disolución.
Fíjate que el concepto clave es la disociación. ;)
Un saludo,
Breaking Vlad
-
El peso molecular de un gas es 44.02.Hallar su densidad relativa respecto al aire. Respuesta :1.580 No comprendo como con el peso molecular puedo hallar su densidad .Gracias
-
Agradecería mucho que alguien me ayudase con este problema, ya que no se ni por donde empezar, muchas gracias.
Una mezcla de gases, en condiciones normales, tiene esta composición de masas: 2% Hidrógeno, %24 Monóxido de Carbono, %22 Carbono dióxido y %52 Nitrogeno. Calcular presión parcial de todos los ingredientes y la densidad de la mezcla.


Jerónimo
el 18/11/17moles nH2=2/2=1 Fracción molar X de H2=1/4,22=0,24
nCO=24/28=0,86 X CO=0,86/4,22=0,2
nCO2=22/44=0.5 X CO2=0,5/4,22=0,12
nN2=52/28=1,86 X N2=1,86/4,22=0,44
moles totales=4,22
Como en condiciones normales la presión es de 1 atmósfera y la presión parcial de cada gas es igual a la presión total por la fracción molar , en este caso coincidirán PH2=0,24 atm....
La masa molar media será = g totales/moles totales= 100/4,22=23,69 g/mol
Aplicando PM=dRT sale una densidad de 1.05g/l
-
Hola,
¿Alguien me puede explicar un poco la ley que formuló avogadro?
Gracias


Jerónimo
el 18/11/17Gases ideales Gases ideales PV=nRT
Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de partículas
-
Hola, buenos días.
¿Qué ocurre cuando se mezcla CuSO4 y ZnSO4? ¿Y HCl y polvo de Zn? ¿Y HCl con polvo de Cu y añadiendo gotas de amoniaco después?
Muchas gracias.


Jerónimo
el 18/11/17Para responder a esas preguntas necesitas conocer los potenciales de reducción .En un sistema redox el potencial de reducción mayor es el que verifica la r de reducción, así dependiendo de las sustancias o iones que tengas habrá veces que de forma espontánea habrá redox y otras veces el proceso no ocurrirá. Te recomiendo veas los videos de unicoos de reacciones redo.
















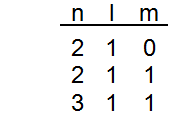 en que se diferencian la orientación de estos orbitales? Entiendo que al tratarse de orbitales P, deben tener un plano nodal. Pero cual corresponde a cada uno? Es el plano YZ para 1 y XZ para 0?
en que se diferencian la orientación de estos orbitales? Entiendo que al tratarse de orbitales P, deben tener un plano nodal. Pero cual corresponde a cada uno? Es el plano YZ para 1 y XZ para 0?



