-
Hola buenas no entiendo este problema:
Una muestra solo contiene CaC2O4 y Cao. una muestra de 1,2 g se calcina a 900ºC produciendo un residuo de CaO que pesa 0,84g. Calcular el porcentaje de CaC2O4 y Cao en la muestra.


Jerónimo
el 15/11/17Al calcinar el oxalato cálcico produce CO2 (gas) y CaO
x=g de CaC2O4 x+y= 1,2 g
y=g de CaO
En 1 mol de CaC2O4 (128 g)----------1 mol de CaO (56g)
En x g de CaC2O4-----------------------?? g de CaO 56x/128= 0,4375x g de CaO
Quedará x+y= 1,2 g
0,4375x +y= 0,84 g
Ya resuelves el sistema de ecuaciones
-
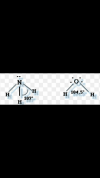
Es necesario dibujar en la estructura de la molécula según TRPECV los pares de electrones no enlazantes ? Como es el caso del N y O en la siguiente imagen:
-
buenos días disculpe alquien me podría decir cual es el mecanismo para el 2-metilbutano a partir del 3-metil-2-butanol y reactivos necesarios .
porfavor ayúdenme porfavor porfavr porfavor lo necesito mucho porfavor porfavor .
discupen alguien sabe de donde puedo sacar información sobre esta sustancia como propiedades físicas y quimas etc. porfavpr lo necesito mucho se los agradecería demaiado
ayúdenme


Breaking Vlad
el 15/11/17Hola Ana, aquí tienes un esquema de lo que pides.
De todos modos, esta es la solución más simple, no es la única opción. Y dependiendo del nivel al que estés estudiando puede que no sea exactamente lo que te están pidiendo.
En cuanto a información sobre dichas sustancias puedes buscar en handbooks, o mismamente en wikipedia (contrastando siempre que las fuentes sean correctas)
Un saludo,
Breaking Vlad
-
La formación de Oxidos (óxidos básicos) para los metales alcalinos (Grupo IA). Balancear las ecuaciones, indicar sus nombres e identificar cuales son reactivos y cuales productos.


Breaking Vlad
el 14/11/17se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)
-
En cinética química, la presión solo influye en reacciones en fase gaseosa?
-
podeis ayudarme?
- La hematita, Fe2O3, es un mineral muy importante en la industria para producir hierro. El metal libre se obtiene por la reacción de la hematita con CO, obteniéndose CO2.
- Escribe y ajusta la reacción química correspondiente. (0,4 puntos)
- Calcula la masa de Hierro (Fe) que se puede obtener a partir de 2000 kg de un mineral con una pureza del 65% en óxido si el rendimiento de la reacción es del 45%. (0,8 puntos)
- ¿Qué volumen de CO2 medido en condiciones normales ( T= 273 K y p= 1 atm) se formará? (0,8 puntos)


Breaking Vlad
el 14/11/17Te sugiero este video..
Estequiometria 02
A partir de ahí, se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)