-
Hola alguien me podría ayudar en este ejercicio: Se titula una solución problema de 25 ml de hcl 0.1M con naoh 0.1M. Se añade la base en porciones de 5 ml cada una. Calcular el ph hasta el punto de equivalencia después de cada porción añadida considerando los volúmenes aditivos? Si alguien me lo puede explicar con meq se lo agradecería... :D


David
el 6/3/17Echale un vistazo... Valoracion ACIDO fuerte BASE fuerte
A partir de ahí, se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-) -
Hola, alguien podría ayudarme con esto de química orgánica? A mí la respuesta me da la A, pero dicen que es la C. Y no entiendo por qué ya que primero le doy prioridad a los enlaces, y por ambos lados quedarían con 1 y 3, así que luego miraría por cuál lado quedan con menor número los sustituyentes, por lo tanto me daría la A. No sé si estoy haciendo algo mal.
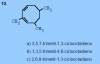
-
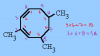
Hola, buenas noches! Si no es mucha molestia, podría alguien ayudarme a entender el razonamiento de este problema, más concretamente, no comprendo cómo plantea el sistema. ¿Alguna ayuda?
Muchas gracias de antemano!

Francisco Javier
el 4/3/17Tanto el Na(OH) como el Ca(OH)2 son bases, así que cuando neutralices con HCl neutralizarás ambas. Fijate que por cada hidróxido de calcio tienes 2 OH, así que necesitaras 2 moles de HCl por cada mol del hidróxido de calcio.
Para la neutralizacion, los moles de base tienen que ser igual a los moles del ácido, entonces nos quedaria: Moles NaOH+ 2*Moles Ca(OH)2 = Moles HCl.
Los moles los puedes relacionar con la masa, de la siguiente manera: Moles=gramos/Masa molecular. Lo sustituyes en la ecuacion anterior para cada compuesto y te queda esto:
g NaOH/Mm NaOH+g Ca(OH)2/Mm Ca(OH)2= Moles HCl
Por otro lado tienes una muestra de 0,77 g. Esto significa que g NaOH+g Ca(OH)2 =0,77 g
Como esos 0,77g los disuelves en 100 ml y luego de esos solo coges 10 ml para neutralizar, estas diluyendolo 10 veces, es como si cogieras 10 veces menos masa. Por eso la ecuacion anterior te aparece así:
g NaOH+g Ca(OH)2 =0,77/10 g
Yo sinceramente prefiero haber multiplicado los moles de HCl que se han necesitado para neutralizar por 10 (Una simple regla de 3, si para 10 ml se gastan esos moles, para 100 ml que es el total se gastaran 10 veces más), pero como el ejercicio te lo pone así...
Bueno, ya tienes 2 ecuaciones con dos incógnitas, lo unico que han echo es llamar x a los g del hidróxido de sodio e y a los gramos de hidróxido de calcio.
Espero que con esto te halla aclarado algo.
-
En química orgánica, cuando tienes una cadena con radicales, dobles y triples enlaces, qué componente es el que tiene preferencia para llevar el menor indicador? Estoy hecha un lío! :(
-


David
el 6/3/17Revisa estos videos... Gases ideales
Debes aplicar Po.Vo/To = P.V/T...
A partir de ahí, se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-) -
En cuanto a la configuración electrónica del iones Fe3+, ¿por qué termina en: 3s2 3p6 3d5? y ¿por qué no termina en: 3s2 3p6 4s2 3d3?
Gracias

Francisco Javier
el 3/3/17El orbital 4s es de menor energia que el 3d(aunque en los metales de transicion la diferencia energetica es poca) por eso se suele llenar antes el 4s que el 3d, pero encuanto a distancia del nucleo, los orbitales 3d estan mas cerca que los 4s. Cuando eliminas un electron, estas haciendo que la misma carga positiva proveniente del nucleo atraiga a menos electrones, por lo que cada electron se ve mas atraido hacia el nucleo, pasando ahora a ser los orbitales 3d menos energeticos que los 4s. Esto es aplicable a practicamente todos los metales de transicion
Espero que te ayudara
-
El enunciado del problema es el siguiente: "En el espectro del hidrógeno se detecta una línea a 1880nm. ¿Es una línea de la serie de Balmer? Justifícalo."
Si no me equivoco, por ser línea de Balmer, en cuanto a la ecuación de Rydberg, n1 = 2, ¿verdad?
Es que en el solucionario, coge n1 = 4, pero no entiendo porque coge cuatro si hablamos de la línea de Balmer.
Gracias
-
En cuanto a los isótopos, qué es la abundancia natural?
Gracias

Francisco Javier
el 3/3/17Es el porcentaje que hay de cada isotopo. Es decir, la proporcion en que se encuentran cada uno. Por ejemplo, imagina 1000 atomos de hidrógeno, de esos, 990 son H sin neutrones, alomejor 8 son deuterio(H con 1 neutron) y los otros 2 son tritio(H con 2 neutrones). Si haces el porcentaje de cada uno, hallas la abundancia natural de cada isotopo.
ojo, los datos me los he inventado, no se el porcentaje de cada isotopo del H, es solo un ejemplo.
Espero que te ayudara.
-
Buenas noches unicoos,me podrian ayudar con este ejercicio por favor.
El aire de un neumático de automóvil , de volumen de 30 lts, està a la presiòn de 2 atmósfera s.¿Cuánto aire saldría del neumático si se abriese la válvula? .Suponer que el volumen del neumático es constante, así como la temperatura

Francisco Javier
el 3/3/17Para este ejercicio solo tienes que usar la ecuacion de los gases ideales, PV=nRT. Tienes la temperatura, volumen y R constantes, por lo que si dejas todo lo constante en el mismo lado de la ecuacion te quedaria P/n=RT/V. Como eso se tiene que mantener constante, podemos decir que P1/n1=P2/n2. P1 seran las 2 atm iniciales, y P2 1 atm, ya que es la presion exterior. Te quedaria 1/n1=2/n2. Elevas a -1 ambos lados de la ecuacion para que queden los moles arriba: n1=n2/2 y podemos ver que cuando se iguala la presion tenemos la mitad de moles de aire.
Saldria exactamente la mitad del aire de la rueda
-
Buenas noches, a ver si puede alguien ayudarme con este problema de ácido-base:
De un frasco que contiene HCl del 25% en peso y densidad 1,09 g/mL se toman con una pipeta 20 mL y se vierten en un matraz aforado de 200 mL, enrasado con agua hasta ese volumen.
Me pide que calcule el pH de la disolución diluida y no sé como hacerlo..
Hay otro apartado pero supongo que es independiente en el que te pide el volumen de una disolución de NaOH 0'5 M necesario para neutralizar 20 mL de la disolución diluída, creo que no tiene relación con el pH pero eso me da como resultado que el volumen será 30 mL, por si sirve.
Gracias

Francisco Javier
el 2/3/17Lo más importante para saber el pH es conocer la concentración del ácido en mol/L asi que lo primero que tienes que hacer es saber cuantos moles de HCl cojes. Para saber los moles primero tienes que conocer los gramos de HCl que tienes. Como lo mides el volumen con la pipeta, gracias a la densidad que te dan puedes obtener los gramos:
d=m/v Despejando la masa, m=d*v=1,09*20=21,8 gramos.Eso sería el 100%, hacemos el 20% (21,8*0,25=4,36g)[Me he dado cuenta de que la disolucion es al 25% al final, perdon por el error, pero el procedimiento es el mismo]. Ahora para conocer los moles aplicamos su correspondiente fórmula: n=g/Mm (gramos/Masa molecular) n=4,36/36,5=0,119 moles de HCl.
Lo que haces a continuacion es añadir esos moles al matraz de 200 ml, por lo que tendras 0,119 moles del ácido en esos 200 ml. Aplicando la fórmula de la molaridad, M=n/L=0,119/0,2 (Importante el volumen en litros)=0,597M
El HCl es un ácido fuerte que se disocia completamente, por lo que en el agua se encuentra todo forman H+ y Cl- . Esto significa que la concentracion de H+ que necesitas para conocer el pH es igual a la concentracion de HCl que acabamos de calcular, es decir, 0,597M. Ahora es simplemente aplicar la fórmula del pH, pH=-log[H+]=-Log0,597=0,22.
Para el segundo apartado, es importante tener en mente la reaccion que se lleva a cabo, que es la siguiente:
HCl+NaOH->NaCl+H2O
Es decir, necesitamos los mismos moles de NaOH que de HCL para que esta se neutralice. Lo primero que tenemos que averiguar son los moles de HCl que tenemos en los 20 ml de la disolucion. Aplicando la misma fórmula de la concentracion: M=n/L despejamos ahora n que es lo que nos interesa, n=M*L=0,597*0,02=0,0119 mol
Necesitamos los mismos moles de NaOH, y tenemos la concentracion de la disolucion de la que vamos a sacar los moles, asi que ahora usando la misma fórmula despejamos los L, L=n/M=0,0119/0,5=0,0238 litros=23,8 ml
Espero que te sirva y que con esta base seas capaz de hacerlo tu para la disolucion del 25%
Un saludo














