-
Hola! Tengo dudas con este ejercicio la figura muestra las cuervas obtenida en la valoración del ácido acético llamado también ácido etanóico, y ácido clorhídrico con hidróxido de sodio
A) escribe las reacciones de valoración de los dos ácidos indica razonadamente si el pH en el punto de equivalencia de cada uno de las valoraciones es ácido neutro o básico
La figura no la he adjuntado porque gráficamente se ver el pH en el punto de equivalencia. Pero a partir de las reacciones no...
Hcl + naoh----->nacl + h20
Ch3cooh+naoh----> h20+ ch3coona
Esas son las reacciones de valoracion pero no sé como se ve y que hay que hacer para saber el ph en el punto de equivalencia a partir de las reacciones de valoracion
Gracias :)

Guillem De La Calle Vicente
el 13/8/18Recuerda que en el punto de equivalencia, el pH viene dado por el carácter ácido-básico de la valoración:
- Si tenemos un ácido fuerte y una base fuerte, el pH en el punto de equivalencia es neutro.
- Si tenemos un ácido fuerte y una base débil, el pH en el punto de equivalencia es ácido.
- Si tenemos un ácido débil y una base fuerte, el pH en el punto de equivalencia es básico.
Vamos con tu ejercicio.
Para la primera valoración, tenemos que el ácido acético es un ácido débil y el hidróxido de sodio es una base fuerte. Por tanto, el pH en el punto de equivalencia será básico.
Para la segunda valoración, tenemos que el ácido clorhídrico es un ácido fuerte y el hidróxido de sodio es una base fuerte. Por lo tanto, el pH en el punto de equivalencia será neutro.
Saludos.


Jerónimo
el 16/8/18Para justificarlo debes de repasar el tema de hidrólisis.
En el primer caso, el NaCl formado es una sal soluble completamente disociada en sus iones Na+ y Cl-. El Na+ es un ácido débil conjugado del NaOH (que es una base fuerte) por lo que no sufre hidrólisis y el Cl- es una base débil conjugada del HCl (que es un ácido fuerte) por lo que tampoco sufre hidrólisis y el pH en el punto de equivalencia es 7.
En el segundo caso , el CH3COONa es también una sal soluble disociada en sus iones CH3COO- y Na+. El anión acetato es una base fuerte conjugada ya que procede del ácido acético (CH3COOH) que es un ácido débil.
El CH3COO- por ser base fuerte sufre hidrólisis
CH3COO- +H20-----------------CH3COOH + OH-
Por eso en el punto de equivalencia el pH es básico


Breaking Vlad
el 19/8/18Genial Jerónimo,
esa es exactamente la mejor manera de explicar este efecto. Si te cambian los compuestos simplemente ten en cuenta que en el punto de equivalencia SOLO tienes sal + agua, así que debes ver, que pH otorga la sal en cuestión, si es una sal neutra, básica o ácida.
Un saludo,
Breaking Vlad
-
 Hola tienen algun video de nomenclatura de estas sales??? Y me ayudan a nombrar estas sales? Gracias!!
Hola tienen algun video de nomenclatura de estas sales??? Y me ayudan a nombrar estas sales? Gracias!!

Breaking Vlad
el 19/8/18Hola Nico,
en concreto las de tipo LiH2PO4 (oxisales ácidas) si las tenemos explicadas en: Oxisales según IUPAC 2005
Las sales compuestas (con dos metales, o dos aniones) no están explicadas.
Un saludo,
Breaking Vlad
-
Hola, tres cosas:
1. ¿Qué bases son las fuertes? Tenía entendido que los hidróxidos son fuertes pero en un ejercico el hidroxido de cobre salía con dos flechas entonces no sé muy bien cuales son fuertes y cuales no en cuanto a bases.
2. Si yo tengo una reacción por ejemplo:
HCl (ácido) +H20 (base)---->Cl- (base conjugada )+ H3O+ (ácido conjugado)
El Hcl sé que es un ácido fuerte, pero su base conjugada es fuerte o débil? Es decir siempre que tenga un ácido (si este es fuerte o débil) su base conjugada será fuerte (si el ácido es fuerte) o debil (si el ácido es débil)? O va al revés?
Supongo que lo mismo pasaría con las bases fuertes/débiles y sus ácidos conjugados
3. Sabéis de alguna página en que estén todas las formulas de 2 de bachillerato por temas?
Gracias :)


Breaking Vlad
el 12/8/18Hola E,
el hidroxido de cobre es una base débil porque es insoluble, y está regido por Kps, y eso pasa con muchos otros hidróxidos. (por cierto Jerónimo, no sé de donde sacaste esa tabla, pero hay hidróxidos mal formulados)
Los hidróxidos son todos bases fuertes por norma general, el problema es que gran parte de ellos son poco solubles, y por lo tanto, tienen una actividad menor.
En cuanto a ácidos-bases conjugados, siempre es a la inversa: ácido fuerte -> base débil, y viceversa.
En cuanto a las fórmulas de segundo de bachillerato por temas, las puedes encontrar en esta misma web.
Un saludo,
Breaking Vlad
-
¿Cuáles de las siguientes expresiones son verdaderas y por qué?Teniendo en cuenta que se refieren a una disolución acuosa 1 M de un ácido fuerte HX:
a) La concentración de X- es 1M
b) La concentración de HX es 1M
c) La suma de H+ y X- es 2M
d) El pH es cero -


Breaking Vlad
el 20/8/18Hola! Me encantaría ayudarte, pero no respondo dudas universitarias que no tengan que ver específicamente con los videos que ya he grabado como excepcion. O de otras asignaturas que no sean matemáticas, física y química. Lo siento de corazón… Espero lo entiendas
Ojalá algun unicoo universitario se anime a ayudarte (de hecho lo ideal es que todos los universitarios intentarais ayudaros los unos a los otros)
-
Hola, tengo una duda más tengo este gráfico
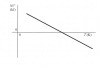
y me piden que diga si es exotérmica o endotérmica.
Pensé en hacerlo a partir de la formula: ΔG=ΔH-T·ΔS
ΔS lo tuve que calcular en un apartado y es positivo, la temperatura sé que es positiva pero ΔG en parte del gráfico es positivo y en otra parte negativo..., así que no puedo ver si ΔH> o <0 para saber si es endotermica o exotermica
Se puede ver gráficamente?
Gracias de nuevo :)


Jerónimo
el 9/8/18Leyendo el problema de nuevo y al decir que la entropía es positiva se puede deducir el signo de la entalpía.
A partir de ΔG=ΔH-T·ΔS
El factor T·ΔS siempre tendrá signo negativo.
A T bajas ΔG es positivo (no espontáneo y a T altas ΔG es negativo (espontánea).
A partir de ésto por deducción la entalpia debe ser positiva (proceso endotérmico)


Breaking Vlad
el 9/8/18Este ejercicio es más simple de lo que parece.
Tienes ΔG = ΔH - TΔS
tienes graficado en el eje Y la variación e G y en el eje X la temperatura. Para saber cual es la entalpía solo has de buscar que T = 0
Cuando T=0, ΔG = ΔH. Así que si en T=0 ΔG > 0, la entalpía también. Esa reacción es endotérmica.
Un saludo,
Breaking Vlad
-
Cómo sé cuando la solubilidad de un compuesto en agua destilada es más alta o más baja que en otro compuesto?
La verdad no sé en qué me tengo que fijar
Gracias:)


Breaking Vlad
el 9/8/18También influyen otros aspectos, la misma solubilidad. Te recomiendo mirar tablas de solubilidad. Por ejemplo en agua destilada NaNO3 se disuelve bien, sin embargo PbI2 no. Por la propia insolubilidad del compuesto.
Otra regla importante es "semejante disuelve a semejante" de modo que disolventes polares disolveran sustancias polares y viceversa.
Espero haber aclarado un poco más tu duda,
un saludo,
Breaking Vlad