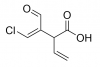
-
¿Cuál de los siguientes compuestos tiene mayor porcentaje de litio?
a) Carbonato de litio: Li2CO3
b)Hidróxido de Litio:LiOH
Datos: Li:7u, C:12u, O:16u, H=1u
Ayuda

Guillem De La Calle Vicente
el 20/7/18a) Masa molecular del Li2CO3 = (2 · 7) + (12) + (3 · 16) = 74 u.
Porcentaje de litio en el compuesto: (14 / 74) · 100 = 18'919 %
b) Masa molecular del LiOH = (7) + (16) + (1) = 24 u.
Porcentaje de litio en el compuesto: (7/24) · 100 = 29'17%
Por tanto, el hidróxido de litio tiene mayor porcentaje de litio.
Saludos.
-
número de moles y numero de moléculas que hay en 210 g de agua
Estaría bien planteado de la siguiente forma.
número de moles:
n=210g/18g/mol=11,66moles hay en 210 g de H2O.
número de moléculas
1mol--------6,022·10^23moléculas
11,66moles-------x
x=
-


Jerónimo
el 19/7/18Tienes que usar la ecuación de Arrhenius; la constante de velocidad, la temperatura y la energía de
activación se relacionan por:
K=A e^-Ea/RT
sin catalizador K=A e^-184000/600R
con catalizador Kc=A e^-59000/600R
Dividiendo una expresión entre otra queda
Kc/K=e^-59000+184000/600R=7,6x10^10
El catalizador de platino disminuye la energía de activación; y acelera la reacción en un
factor de 7,6x10^10 cuando ocurre a 600 K.
-
Hola tengo un ejercicio que no puedo resolver: Calcular el volumen de agua que es necesario agregar a 50 ml de una solución de sulfato de sodio a 25% m/m y densidad 1.15 g/ml para obtener una solución de esa sal 1 molar. Considere volúmenes aditivos
-
Para el equilibrio PCl5 (g) ↔ PCl3 (g) + Cl2 (g) la KP vale 2 a 270 ºC. Calcular la presión de los gases en el equilibrio que se alcanza cuando se hacen reaccionar 0,1 moles de PCl3 con 0,2 moles de cloro en un tanque de 20L A 270ºC
-
Necesito ordenar por viscosidad las siguientes moléculas: CH3CH(OH)CH2OH ; CH3CH2OH ; CH3CH2SH ; CH3CH2CH2OH. Primero he mirado los enlaces de hidrógeno que hay, pero en el caso de la segunda y la cuarta que hay sólo 1, no sé qué criterio se utiliza ahora. Gracias
-
¿para la combustión del octano (C8H18) se obtiene 2lt de agua. Calcular?
a)Reacción principal.
b)Moles de oxigeno.
c)Gramos de octano.
d)Moléculas de dióxido.
e)Moléculas de oxigenoPor favor con procedimiento. Gracias


Breaking Vlad
el 19/7/18Te sugiero este video..
Moles de átomos y moléculas
A partir de ahí, se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)
-
El volumen molar del CO es 22,40Lmol-1 y el del CO2 es 22,26Lmol-1, a 0 ° C y 1,0atm. Determine el volumen molar de un gas ideal en estas condiciones y justifica el posible desvío del comportamiento ideal de los dos gases a partir de la teoría Cineticomolecular los gases.
Calcule el volumen y me dio 22,38 l
(Explique en que consiste la teoría cineticomolecular de los gases) y a continuación puse que el CO2 se desvía más de este comportamiento debido a que tiene mayor masa molecular por tanto las fuerzas intermoleculares en el CO2 gaseoso son mucho más fuertes
Pero no sé si está bien, a mayor masa molecular hay más fuerzas intermoleculares o me lo he inventado yo?
Gracias :)
-
El calor de formación de AgCl(s) en condiciones normales es de , -30,3Kcal/mol y la entalpía de la reacción Pb (s)+ 2AgCl(s)↔PbCl2 +2Ag (s) vale -25,1 Kcal en las mismas condiciones. Calcula:
a) El calor de formación del PbCl2 (s)
b) Calor que se genera en el proceso cuando reaccionan 1,84x1024 çatomos de Pb (s)
DATOS: NUMERO DE AVOGADRO 6,002x1023