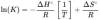-
Se añade lentamente KI(aq) a una disolución con [Pb2+]= [Ag+]= 0,01 M. Para PbI2, Kps = 7,1×10-9; para AgI, Kps = 8,5×10-17.
¿Qu precipitado se formará primero, PbI o AgI?
¿Qué valor debe tener [I-] para que el segundo catión empiece a precipitar?
¿Qué concentración del primer catión queda en la disolución sin precipitar, cuando empieza a precipitar el segundo catión?
En el a, precipita primero el AgI, ¿no?. Los otros dos apartados no sé hacerlos.


Jerónimo
el 14/1/18Precipitará antes el que necesite menos concentración de I-
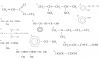
PbI2 (s) ------- Pb+2 +2I-
Kps=[Pb+2] [I-]^2 [I-]=√Kps/[Pb+2]=√7,1 x10^-9 /0,01=8,4 x10^-4 M
AgI(s)----------- Ag+ +I-
Kps=[Ag+] [I-] [I-]=Kps/[Ag+ ]=8,5 x10^-17 /0,01=8,5 x10^-15 M
Precipita antes el AgI
b) Piden [Ag+]=? cuando [I-] =8,4 x10^-4
[Ag+]=Kps/[I-]=8,5x 10^-17/8,4x10^-4 =1x10^-13 M
-
Las reacciones químicas y cambios de fase son procesos que se llevan acabo a temperatura constante. ¿Cómo se puede determinar en ambos procesos el ΔE, ΔH, q y W?
Yo responde que para los ΔE y ΔH seria igual a cero, sin embargo la relación del calor y el trabajo para una ΔT=0 q= -W
Esta bien la respuesta?
-
Holaa!! Espero que me aclaren las dudas con respecto a estas 3 preguntas teóricas:
1- Es verdadero o falso, justifique. q=0 en todo el proceso cíclico.
2- Es verdadero o falso, justifique. Dado que en la fusión del hielo, la T se mantiene constante entonces U=0.
3- Es verdadero o falso justifique. El W rev. (Expansión isotérmica) es igual al W irrev. (Expansión).
Espero que me puedan ayudar.


Jerónimo
el 13/1/181- Falso porque el calor no es una función de estado y solo las funciones de estado en los procesos cíclicos su variación es cero.
2- verdadero porque el calor suministrado no se utiliza en variar la energía interna sino en romper los enlaces
3- Falso porque si el trabajo es reversible ( sistema ha regresado a su estado inicial y el entorno también ) y no se ha realizado un trabajo neto., en cambio si el trabajo es irreversible sí hay trabajo neto.
-
Hola, quería preguntar cómo diferenciar los enlaces intermoleculares de los covalentes, iónicos y metálicos?
Muchas gracias :)
-
Cual es el ion mas estable del carbono ?
su estructura electronica acaba en 2s2 2p2,
su ion debe de cumplir la regla del octeto, pero puede tanto ganar como perder electrones


Jerónimo
el 13/1/18Te aconsejo te veas estos videos de hibridación
Hibridación spHibridación sp2 Hibridación sp3 Hibridación | Concepto
-


Jerónimo
el 13/1/18Combinando ΔG=ΔH-TΔS y ΔG=-RTlnK llegas a esta expresión
Es la ecuación de una recta y=mx+n
Representas ln de la constante de equilibrio medidos para cierto equilibrio frente al inverso de la temperatura se obtiene una recta, cuya pendiente negativa es igual a la variación de la entalpía dividida entre la constante de los gases, y la ordenada en el origen es igual a la variación de entropia dividida entre la constante de los gases.
-
En el apartado c del ejercicio 6 cuando pone que se reduce a la mitad el volumen de la reacción porque ponemos que la molaridad de cada uno se reduce a la mitad? El volumen de ambos reactivos se reduce a la mitad? No lo entiendo porque pensaba que los volúmenes eran aditivos y entonces se reduce a una cuarta parte el de mada reactivo