-
Me podéis ayudarme con esa pregunta? No sé cual de los tres postulados de Bohr explica el error de Rutherford.
El modelo de Rutherford no explica porque los electrones al girar alrededor del núcleo no acaban cayendose, segun indican las leyes del electromagnetismo. ¿Como explica Bohr esta cuestión?
-


Breaking Vlad
el 15/10/17Te sugiero este video..
Estequiometria 02
A partir de ahí, se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)
-


Breaking Vlad
el 15/10/17Te sugiero este video..
Riqueza o tanto por ciento en masa
A partir de ahí, se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)
-
Una pregunta ¿En una reacción química los moles finales son iguales a los iniciales de una sustancia? La masa sí se conserva ¿y los moles?


Breaking Vlad
el 15/10/17Hola Lourdes,
Se conservan los moles de cada uno de los átomos, y por lo tanto, las masas. Mira tienes esta reacción por ejemplo:
2 NO2 -> N2O4
En esta reacción partes de 2 moles y acabas con 1 mol. Los coeficientes estequiométricos no se conservan. Sin embargo, si miras los moles de N en cada lado, son 2, y si miras los moles de O en cada lado, son 4.
Espero haberte aclarado un poco la duda.
Un saludo,
Breaking Vlad
-
Hola, no consigo resolver este ejercicio de producto de solubilidad:
¿Cuantos miligramos de ion manganeso (II) permanecerán sin precipitar como hidróxido de manganeso (II) en 500 mililitros de amoníaco 0,1 M?
gracias


Breaking Vlad
el 15/10/17Te sugiero este video..
Producto de solubilidad 04
A partir de ahí, se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)
-
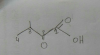
Hola tengo una pregunta.
La nomenclatura de este compuesto es:
Ácido 2-oxo-3-Metil Butanoico o Ácido 3- Metil- 2-oxo Butanoico?
-
Yo lo hice partiendo de 500kg de H2S y calculando los gramos que obtendría de S02 sin tener el % en cuenta para ver si éste estaba en exceso o limitaba la reacción y salia que estaba en exceso ; con lo cual para calcular los gramos de S partí del H2S que limitaría la reacción y por tanto el 36% no lo tuve en cuenta ya que sólo se tomaría en cuenta si partiéramos del S02 ? Muchas gracias :)