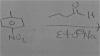-
por que si es REDOX las 2 reacciones se reducen??
-


Breaking Vlad
el 11/4/17Hola Judit,
No se están reduciendo ambas, fíjate bien:
en la segunda reacción tienes los electrones a la derecha, lo que quiere decir que el agua oxigenada está perdiendo electrones y por lo tanto, oxidándose.
De hecho, a la hora de asignar los números de oxidación has cometido un error, en el caso de los peróxidos, el oxígeno tiene número de oxidación -1, con lo que pasa de -1 a 0, y por lo tanto, se oxida.
Un saludo,
Breaking Vlad
-
Hola,me podrían ayudar con este ejercicio:
Justifica que sustancia tendrá mayor punto de ebullición, el Argón (18 electrones) o el Agua (H2O (18 electrones).
-
Buenos días!
Tengo una duda: Molar es equivalente a la concentración de un reactivo? Es que he visto ejercicios de equilibrios que lo hacen con Molar como si fuese la concentración pero no ponen el volumen de la disolución..
Muchas graciaaaas(:
-
Una ayuda para razonar este problema por favor:
.¿Cuántos gramos de agua deben utilizarse para disolver 50,0 gramos de sacarosa (C12H22O11) y preparar una solución de 0,100 molal? De ante mano gracias por su atencion.
-
Una ayudita con el siguiente ejercicio:
Un elemento Y pierde 3 electrones, los números cuánticos para el ión son: n=2 / l=0 / m=0 / s=1/2
Determinar el Z del elemento Y.
Gracias de antemano.

Gabriel
el 20/3/17Hola Martín, a ver si te puedo ayudar...
En primer lugar, hay que saber que Z es el número atómico.
Si n=2, está en el periodo (fila) 2.
Si n=0, está en la subórbita "s"
Si s=1/2, está en el primer grupo (columna) de los orbitales s.
Por lo tanto, sería el elemento Litio, "Li", y este dispone de 3 e-, por lo que si ha perdido el elemento 3 e-, el elemento Y que nos piden tiene Z=6 (Carbono)
Saludos
-
¿Cómo puedo saber si un ácido o una base es débil o fuerte?Gracias!

Guillem De La Calle Vicente
el 20/3/17Antes que nada las bases de acetato son debiles no fuertes, no siempre que un acido o base sean debiles, no quiere decir que su respectiva base o acido conjugados sean fuertes.
A veces basta la simple Ka o Kb poara saber si un acido o base es fuerte, como para el HCl y NaOH.
Pero por ejemplo el Na2S, tiene una Kb de 10^-2, como saber si es debil o fuerte.
Entonces ponemos el equilibrio
.....S(2-) + H2O ==== HS- + OH-
in....Co
eq...Co(1-x).................Cox.....C...
La correspondiente ec de la Kb es:
Kb =[Cox][Cox]/[Co(1-x)]
Kb = Cox2/1-x
Kb/Co = x2/1-x
Como vemos x la fraccion asociada, en este caso (para los acidos dicociada), depende de dos factores Kb y Co, que es la concentracion inicial de Na2S.
Si consideramos que para que este completamente disociada y damos un valor a x digamos de 0.97.
Entonces los valor de Kb en caso de base o acido fuerte serian x = 0.97
Kb/Co = (0.97)^2/1-0.97 = 0.94/0.03 = 31.36
Cuando es base o acido debil, x = 0.03
Kb/Co = (0.03)^2/1-0.03 = 0.0009/0.97 = 9.27x10^-4.
Asi de esta manera sabemos la fuerza de un acido o una base.
Si es fuerte Ka/Co o Kb/Co debe ser mayor de 31.36.
Si son debiles Ka/Co o Kb/Co debe ser menor a 9.27 x 10^-4.
Cuando el valor es intermedio entre los valores anteriores entonces no hacemos ninguna aproximacion y desarrollamos la formula hasta llegar a cuadratica
Kb/Co = x2/1-x
Kb/Co - Kb/Cox = x2
x2 + Kb/Cox - Kb/Co = 0
entonces resolviendo esta ecuacion podemos conocer x y el valor de Cox que corresponde ene este caso a la concentracion de [OH-]y posteriormente pOH y el pH.
Mismo caso que se puede aplicar si tuvieramos una ecuacion de la disociacion de un acido.. -
Alguno que pueda ayudarme con estas preguntas. No logro hacer los factores de conversión.


Guillem De La Calle Vicente
el 20/3/17Se disuelven 8 moles de H2S...
El peso molecular del H2S es 34g/mol, si tenemos 8 moles de este, la masa de H2S =moles x peso molecular= 8 mol x 34g/mol = 272 g, si la solución es masa de agua + masa de H2S = 5000 g, masa de agua agregada es 4728 g que equivale a 4728 mL de agua si la densidad de esta es 1g/ml
-


Breaking Vlad
el 11/4/17Hola! Me encantaría ayudarte, pero no respondo dudas universitarias que no tengan que ver específicamente con los vídeos que ya he grabado como excepción. O de otras asignaturas que no sean matemáticas, física y química. Lo siento de corazón… Espero lo entiendas
Ojalá algun unicoo universitario se anime a ayudarte (de hecho lo ideal es que todos los universitarios intentarais ayudaros los unos a los otros)