-
-
-
Hola, como se resuelven este tipo de problemas? Mezclo una disolución (A) de NaOH de 200ml y 1,5M, y otra disolución (B) de NaOH de 150ml y 20g/L y me piden la concentración de la disolución resultante. El resultado debe ser 1,07M. He probado a resolverlo encontrando los moles de las dos disoluciones, sumándolos, y sumando los volúmenes para calcular la molaridad.
Disolución A
200·10-3L x 1,5mol/L = 0,3 moles
Disolución B
150ml ; 20g/L
20g NaOH /1 L Diss x 1 mol NaOH / 40g NaOH = 0,5 moles
Moles totales = 0,8 moles ; Volumen total = 350ml
Molaridad = 0,8 / 350·10-3L = 2,28 M
Donde me equivoco? Como se resuelven este tipo de problemas? Gracias
-
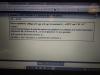
Hola de nuevo, vuelvo a tener por problemas de ajuste por ión electrón. He estado haciéndolos como me recomendaron y todos bien pero este en particular no lo he podido resolver. Lo dejo por si alguien puede ayudarme


Jerónimo
el 5/9/18KI+H2SO4+K2Cr2O7---------------K2SO4+H2O+Cr2(SO4)3+I2
3 x ( 2I- --------------------------- I2 +2e-)
6e- + 14H+ Cr2O7-2 ---------2Cr+3 +7H2O
---------------------------------------------------
6I- +14H+ Cr2O7-2 -----------3I2 +2Cr+3 +7H2O
6KI+7H2SO4+1K2Cr2O7---------------4K2SO4+7H2O+1Cr2(SO4)3+3I2
-
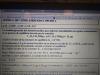
 Hola buenas, me podéis ayudar? Lo podéis corregir y decirme qué hacer con la temperatura, no sé si esto está bien, mal o cómo terminarlo, gracias.
Hola buenas, me podéis ayudar? Lo podéis corregir y decirme qué hacer con la temperatura, no sé si esto está bien, mal o cómo terminarlo, gracias. 

Breaking Vlad
el 5/9/18permíteme añadir,
multiplicar por 100 al final no tiene sentido porque lo que estás calculando son concentraciones, no porcentajes.
Si obtienes un valor de: 0,0364 M, no tiene sentido multiplicarlo por 100, porque no es un porcentaje, sino una concentración.
Un saludo,
Breaking Vlad