-
Hola!
Me podriais ayudar para ajustar una reacción, es que la profesora dice que es imposible, pero según nos dijo ella, todas se pueden hacer de un modo o de otro.
Ag+HNO3→NO+H2O+AgNO3
MUCHAS GRACIAS DE ANTEMANO.
-
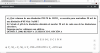
Buenas, ¿me podrían ayudar con el b) de este ejercicio, pues no consigo entender por qué se hace así.
Muchas gracias.

María
el 14/4/18Tienes que calcular los moles de cada reactivo (n=MxV) teniendo en cuenta su molaridad y su volumen (0,05L), y luego teniendo en cuenta la estequiometría de la reacción averiguas que reactivo está en exceso, y luego con los moles que hayan en exceso y el volumen TOTAL ( 0,1L) calculas la molaridad del exceso de ese reactivo y estableces la ecuación de la reacción de disociación de esa sal en la cual la concentración de OH- o H3O+ según el reactivo que sea (el ácido o la base) será la misma que la molaridad que has calculado del exceso y ya haces: pH=-log[H3O+] o pOH=-log[OH-] según el caso.
-
si en un ajuste de una reacción redox, una de las dos semirracciones da que no tiene ninguna carga, la de arriba habría que multiplicarla por 0 o por 1???
-
Si solo te dan la densidad(1´86 g/cc) y el porcentaje masa(96%) de la formula H2 SO4 como sacas la molaridad?
MUCHAS GRACIAS


Rafael S.
el 14/4/18Recuerda que la formula de molaridad es M= Moles de Sto / Volumen de Sol
Sí te dan el porcentaje masa, ya te están dando dos datos: 96gr de Sto en 100gr de Sol.
Me parece que a partir de acá es sencillo... Con la densidad hayas el volumen de la solución y el sto lo pasas a moles y ya está.
Ejercicio resuelto.
-


Breaking Vlad
el 13/4/18Te sugiero este video..
Configuración Electrónica y Diagrama de Moeller
A partir de ahí, se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)
-


Breaking Vlad
el 13/4/18Te sugiero este video..
Configuración electrónica y números cuánticos. Moeller AUFBAU
A partir de ahí, se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)
-
¿si un electrón pasara desde el orbital 5s al 6s, emitirá energía luminosa que daría lugar a una linea en el espectro de emisión?
-


Breaking Vlad
el 12/4/18Te sugiero este video..
Disoluciones 02
A partir de ahí, se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)