-
Entonces... ¿1 MOL se encuentra en un solo átomo?

Pablo Reyes
el 22/1/17Nooooooooooooo!!! Un mol contiene 6,022x1023 átomos. Es el número de avogradro.
Qué pesa más un mol de Hierro o un mol de Potasio? Pues pues pesan lo mismo.
Peeeero, un mol de hierro pesa 55,85 u.m.a y el de potasio 39,10 u.m.a que cuando hagas factores de conversión vas a tratar esas u.m.a como los gramos que contiene un mol de ese elemento.
Es confuso el pensar que 1 mol de algo pesa lo mismo que 1 mol de otra cosa siendo que para cada elemento necesitas una cantidad x de gramos para formarlo distinta que la del otro pero bueno , espero haberte ayudado.


David
el 22/1/17Te sugiero revises los videos de esta leccion... QUIMICA moles de átomos y moléculas
Para intentar resolver tu duda, un mol de agua tiene una masa de 18 gramos. Y un mol de hierro tiene una masa de 56 gramos. -
Tengo unas dudas sobre este ejercicio.

Tengo que decir cual es la sutancia pura. Escogí la F
Donde hay mezclas. Escogí A,B y E
Cuales son las mezclas homogeneas y heterogeneas. Homogeneas escogí C y F. Heterogeneas escogí A, B, D y E
Identificar: Mezcla Homogenea de agua y sal. Escogí el A
Hielo y agua. Escogi el B
Agua y vapor de Agua. Escogi el C
Mezcla de agua y sal (en el fondo la sal). Escogí la E.
¿Lo tendría todo bien? o ¿Cuales son mis errores? Ayuda gracias
-
¿diferencias entre mezclas homogeneas y heterogeneas? ayuda por favor
-
Hola buenos días, necesito ayuda en este ejercicio. Es el siguiente: ¿En qué se diferencian las mezclas de las sustancias puras? Yo solo he puesto que las mezclas es un conjunto de sustancias distintas. No sé si está bien o mal, aún así necesitaría algunas diferencias más. ¿Alguien me ayuda? Gracias ^^!

Natalia Moreno
el 22/1/17Las sustancias puras son los compuestos y elementos, ellos sufren reacciones químicas , mientras que las impuras son las mezclas que pueden ser ya sean homogéneas (soluciones) o heterogéneas . Estas no sufren reacciones químicas, si no que tienen métodos físicos de separación.
-
Hola ! Estoy estudiando sobre el tema número de avogadro, masas Molares, atómicas etc. El problema es que he encontrado un problema 1er parte ) y he tratado de resolverlo como me enseñaron en la escuela 2do parte ) el problema es que no consigo los mismos resultados . En que estoy fallando?

Gabriel
el 22/1/17Ahora sí, a ver si te puedo ayudar...
a) bien
b) En primer lugar, la relación del Número de Avogadro es 1 mol - 6,022·1023moléculas. El resultado que pusiste en la segunda parte lo tienes bien aunque veo que en el Número de Avogadro mal. Pero bueno, por si acaso.
Así que para 4 moles · 6,022·1023moléculas/1mol=2,41·1024moléculas
c) En este caso, para 1molécula de H20, tenemos 3 átomos.
2,41·1024moléculas·3átomos/molécula=7,23·1024átomos
d) Para 1 molécula de H20, tenemos 2 átomos de hidrógeno.
2,41·1024moléculas·2átomos/molécula=4,82·1024átomos
e) Para 1 molécula de H20, tenemos 1 átomo de oxígeno.
2,41·1024moléculas·1átomos/molécula=2,41·1024átomos
Esto es todo, espero que te haya servido. Saludos.
-
Necesito ayuda con este problema :c
En un recipiente de 5 litros a 690 K, se mezclan 0.5 mol de CO2, 0.5 mol de H2 y 0.3 mol de CO, y se establece el siguiente equilibrio a dicha temperatura, según la reacción:
CO2 (g) + H2 (g) <==> CO (g) + H2O (g)
La mezcla de equilibrio contiene 0.114 mol de H2O (g). Calcule la concentración de equilibrio de CO2 (g) en mol/L
a) 2.00 b) 0.023 c) 0.90 d) 0.077 e) Se necesita la constante de equilibrio para el cálculo
Si alguien lo hace que ponga el procedimiento por favor, quiero entender el problema

Roberto
el 21/1/17Hola María,
La reacción es:
CO2 (g) + H2 (g) <==> CO (g) + H2O (g)
Inicialmente: 0,5 0,5 0,3 -
En el equilibrio: 0,5 - x 0,5 - x 0,3 + x x
(en el equilibrio se gasta una cantidad, x, de CO2 y H2, pero se crea CO y H2O, como inicialmente tb había CO en este caso debes tenerlo en cuenta por eso es 0,3 + x)
Como sabes que en el equilibrio se ha formado 0,114 mol de H2O, ya tienes el valor de x. Por tanto, en el equilibrio tendrás 0,5 - 0,114 = 0,386 moles de CO2. Como también conoces el volumen (5 litros), tienes la concentración mol/L, es decir: 0,386/5 = 0,772 mol/L de CO2. Respuesta D)
Un saludo.
-
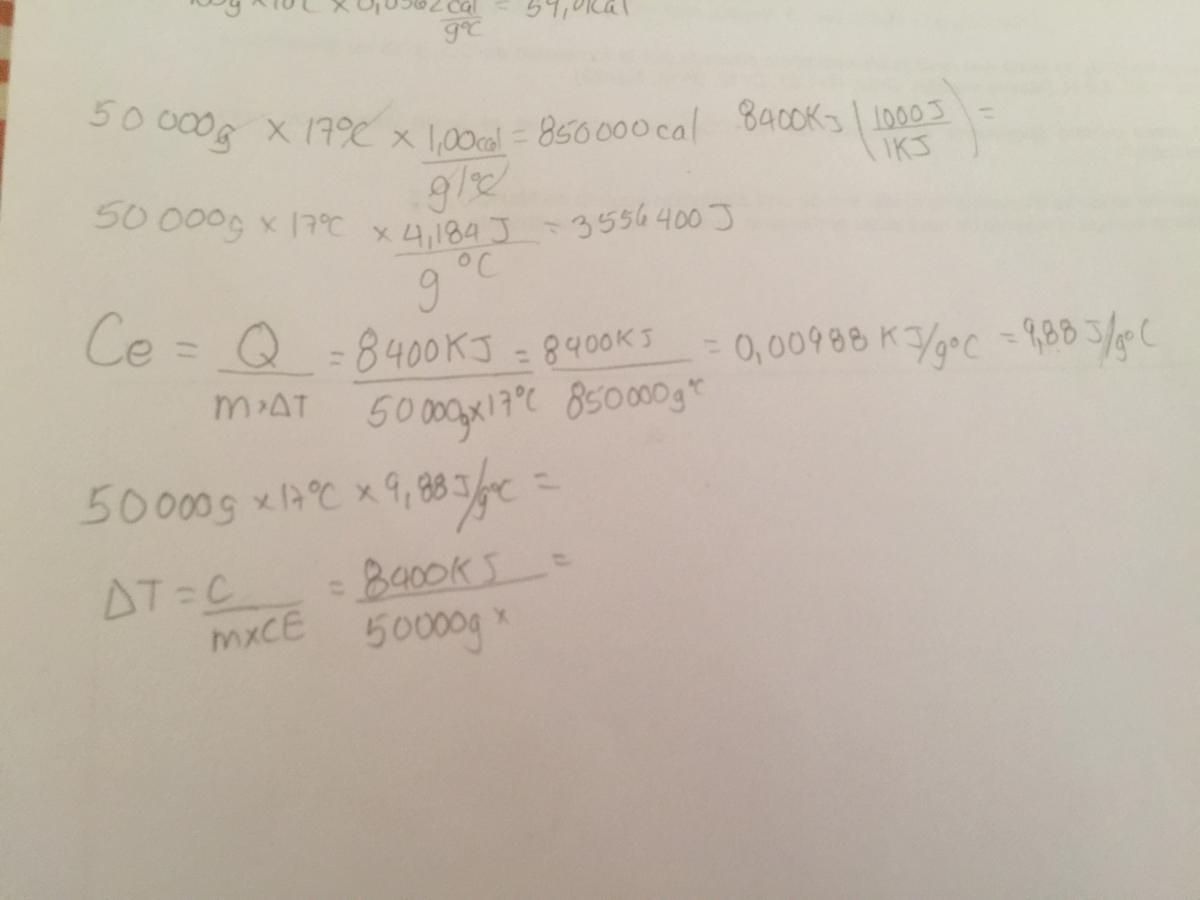 Si los 8400 kilojulios de energia que gasta una persona en un día se emplean para calentar 50 000 g de agua a 20*C, cual sera el aumento de temperatura? Cual sera la nueva temperatura del agua?
Si los 8400 kilojulios de energia que gasta una persona en un día se emplean para calentar 50 000 g de agua a 20*C, cual sera el aumento de temperatura? Cual sera la nueva temperatura del agua? No entiendo que hay que hacer como calcula el aumento de temperatura y cual es la nueva del agua???
Hice un garabato alla arriba enserio que ni idea de que hacer

Roberto
el 21/1/17Hola,
No lo llevas mal encaminado del todo. Usa la fórmula Q = C x m x ΔT (como estás usando), pero despeja de ahí ΔT y teniendo cuidado con las unidades puedes conocer ese incremento de temperatura.
También sabes que ΔT = Tf - To, conoces ΔT porque lo puedes calcular, conoces To = 20 ºC y con eso ya tendrías Tf.
PD: no sé de donde has cogido 17 ºC.
Un saludo.

Roberto
el 21/1/17No no, te dicen "Si los 8400 KJ de energía que gasta una persona en un día se emplea ..." Te dan el dato a modo curiosidad para que veas el potencial energético que tenemos. Pero el sistema no es el cuerpo humano, sino el agua a calentar, las temperaturas deben ser las del agua.

Roberto
el 21/1/17Daniel, has hecho muy bien en plantear el problema e intentar resolverlo, eso, aunque no llegues al resultado final, te ayudará aprender. No es lo mismo intentar resolver un problema que verlo directamente resuelto, no se aprende igual. Así que muy bien tu actitud y sigue así.
Un saludo.
-

Roberto
el 21/1/17Hola Nico,
Al tratarse de gases puedes suponer gases ideales y usar PV = nRT. También sabes que n = masa (m) / masa molecular (Mm), por tanto: PV = (m/Mm)RT. De ahí puedes despejar m:
m = (PVMm)/(RT)
Ahora solo tienes que usar los datos que te dan en los apartados a, b y c.
CN, quiere decir condiciones normales, T 273K y P 1 atm.
Fíjate que en el c te dan ya los moles.
Un saludo.
-
- ¿Cuál es la diferencia entre compuesto y elemento? (No sé lo que es...)
- ¿Cuál es la diferencia entre átomo y molécula? (Átomo creo que lo tengo claro, pero he leído un poco también de la molécula, y no lo entiendo...)

Nico
el 21/1/17Pues que una molécula está formada por varios átomos de distintos elementos.
Compuesto es una forma genérica para hablar de molécula.
Un elememto está formado por un solo átomo como el Carbono, aunque pueden ser diátomicos (que solo existen en la naturaleza como dos átomos, nunca uno solo) como el hidrógeno, el oxígeno, el o el bromo.
Espero harberte ayudado.
















