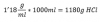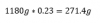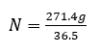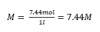-
El oro metalico cristaliza en una red cubica centrada en las caras y la arista de la celdilla unitaria es de 4,07A. Sabiendo que la masa atomica del oro es 197, calcular:
1) el volumen medio ocupado por un atomo.
2) densidad del oro.
Resulta que el volumen medio del 1) lo he calculado (arista)^3 /4 , mi pregunta es: el volumen que tengo que añadir en la densidad del 2) es el mismo que el que he calculado en 1)? o ese nuevo volumen que añado a la formula de la densidad es el de a^3?
¡Muchas gracias!
-
Hola, buenos días, tengo un par de dudas, ¿cómo puedo diferenciar entre 2 o más elementos, cuál presenta mayor valor
para la primera energía de Ionización, radio atómico, afinidad electrónica?
EJEMPLO:
1.- Para los elementos Na y Li, indica el elemento que presenta el mayor valor para la primera energía de ionización:
2.- Ordena los siguientes elementos en forma creciente de su radio atómico:
3.- Indica qué elemento tendrá mayor afinidad electrónica entre Cl, Be, S:
-
Hola a todos.
Por favor necesito aclarar los siguiente:
Tengo la ecuación. Fe + O2= Fe2O3 he visto el balanceo de 2 formas diferentes, cuál es la correcta?
1)4Fe+3O2=2Fe2O3
2)2Fe+(3/2)O2=2Fe2O3
Es importante saberlo ya que la masa molar cambia y cambia el cálculo de moles, gramos, etc.
Gracias
Rocío
-
Hola gente... nunca he tocado la química, y ya voy a tener mi primer examen de ello... estoy intentando entender que es un "MOL" y en parte lo entiendo, pero otra no...
Si 1 MOL es = a 6,02 x 1023 ... ¿Cómo saben que en un montón de guisantes hay 6,02 x 1023 ?
No entiendo muy bien como pueden saber si hay 1 mol en cosas visibles...

Ángel
el 20/1/176,02 x 1023 es el número de Avogadro. Es la cantidad de átomos o moléculas que hay en "un gramo de hidrógeno" o en "12 gramos de carbono 12"
Avogadro contó ese "montón" de particulas elementales a partir del número másico, entre otras variables anteriormente trabajadas por otros científicos anteriores

Si Las Llamara Lágrimas
el 23/1/17A ver Amanda que veo que estás un poco confundida y es normal, supón que tienes 1 mol en de h2o, ¿cómo sabes el peso de 1 mol de H2O? pues con su peso molecular, el H---1g/mol y el O2 ---16g /mol por lo tanto si tienes 1 mol de H2O será : 1 +1 +16 (el 1 corresponde a cada H y el 16 al O) entonces es 18g/mol un mol de H2O , si te preguntan cuánto pesan 20 moles de H2O tendrás que hacer una regla de 3, si 1 mol son 18 g, 20---x saludos!! espero haberte alcarado algo
-
Buenos días:
En un ejercicio de 4ESO me piden la molaridad del hydrochloric acid al 23% m/m con una densidad de 1,18g/cm3. Me lo han pasado en inglés: A hydrochloric acid solution of a commercial reactant al 23%m/m with a dinsity of 1,18g/cm3.
Es sencillo pero quizás me haya equivocado con las unidades. Me sale M=7,41. Podríais comprobarlo? Gracias.
Rocío
PD: qué significa 23%m/m?


Pablo Vivó Martínez
el 20/1/171. El porcentaje peso en peso (% m/m o % p/p, siendo más común éste útlimo), es la cantidad (en gramos) de ácido clorhídrico que hay en 100g de disolución (agua). En definitiva, te dice que el ácido es puro en un 23%. Lo demás es el disolvente (agua en el caso del ácido clorhídrico)
2. Calcular la molaridad del compuesto es sencillo. Solo has de suponer un volumen. Imagina que es 1L.
Según la densidad (1'18g/cm3), sabemos que por cada mL de disolución hay 1'18g. Por tanto, vamos a ver cuánto habría en el volumen que hemos tomado:
Sin embargo, no todo lo que hemos calculado teóricamente es HCl, sino solo un 23%. Hacemos este porcentaje:
Ahora, dividiendo por la masa molar del ácido, obtenemos los moles:
Y para obtener la molaridad, dividimos los moles por el volumen que habíamos pensado al inicio, en Litros.
En este caso, al dividir por 1L, la molaridad es la misma que el número de moles. Todo depende del volumen que escojamos. Si el problema exige un volumen al principio, no hay problema. Si te lo has de inventar tú, la molaridad siempre dependerá del que escojas. Se suele optar siempre por 1L de disolución.
¡Un saludo!
-
Hola, ¿existe el compuesto Hidrogenomanganato de cobre (II)? Tengo esa duda porque si el manganeso tiene números de oxidación 6 y 7 (según mi profesor) seria HMN04 y entonces no se podria hacer la oxisal ácida porque no puede tener carga 0 debido a que no pierde el hidrógeno. Muchas gracias.