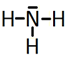-
Hola!! Me pueden ayudar con el ejercicio 14😂. Yo creo que es la misma ya que misma cantidad de protones en el núcleo, así que misma fuerza.. Gracias!!!

David
el 7/11/16LA FUERZA ELECTRICA SE RIGE POR LA LEY DE COULOMB, que es F=k.Q1.Q2/d². Sustituye los datos, sin olvidarte pasar los amstrongs a metros... q1=|q2|=1,6.10^(-19) C
Aun siendo iguales las cargas, el radio atomico es diferente en ambos casos y por tanto la fuerza no puede ser igual...
Abrazos! -
HOLA, VOLVÍ, DESPUES DE UN TIEMPO ESTA VEZ CON QUIMICA, ES QUE SIGO PREPARÁNDOME PARA MIS EXÁMENES A DISTANCIA, ESTA VEZ DE QUIMICA DE 2 DE BACHILLERATO HICE CASI TODOS LOS PUNTOS , AUNQUE ME GUSTARÍA SABER SI ESTAN EQUIVOCADO O NO, PERO PRINCIPALMENTE SI ME PUEDEN AYUDAR CON EL ÚLTIMO INCISO EL d) LO HICE DE VARIAS MANERA PERO NO ESTOY SEGURA SI TENGO QUE HALLAR EL 85% DEL VOLUMEN DE AMONIACO O DE LA LA CANTIDAD DE PRODUCTO QUE ME DAN EN LA LETRA DE ÁCIDO NÍTRICO, BUENO EN FIN, QUE HACE HORAS ESTOY Y NO PUEDO GRACIAS
El ácido nítrico puede obtenerse por el proceso de Ostwald, que implica la reacción inicial de combustión del amoníaco, para producir NO2, que luego se mezcla con agua, según:
4 NH3 (g) + 5 O2 (g) → 4 NO(g) + 6 H2O (g)
2 NO (g) + O2 (g) → 2 NO2 (g)
3 NO2 (g) + H2O (l) → 2 HNO3 (l) + NO (g)
La reacción global es:
NH3 (g)+ 2o 2(g) →→HNO3 (ac) + H2O (l)a) . Indicar si las siguientes son afirmaciones verdaderas o afirmaciones falsas, fundamentando la elección.
i) La reacción global puede considerarse una reacción ácido-base.
No, porque una reacción ácido – base es la que tiene lugar entre un ácido (AH) y una base (BOH) para producir una sal más agua y el amoniaco es una base suave, el ácido nítrico un ácido fuerte
ii) En esta reacción, el oxígeno se reduce y se oxida.
El O es un agente oxidante y por lo tanto se reduce, su estado de oxidación en el producto se reduce con respecto a del reactivos
iii) El número de oxidación del N es el mismo en el NH3 y el HNO3.
No en el NH3 el número de oxidación de N = -3 Y EN HN3 n= 5
b) Escribir la configuración electrónica del N y justificar la relación de la misma con la ubicación en la tabla periódica de este elemento.
1s2 2s2 2p3,
Todos los elementos de un mismo grupo tienen la misma configuración electrónica en su última capa de valencia, logrando así que todos ellos y sus compuestos tienen propiedades químicas similares.
Por esto se puede conocer el grupo al cual pertenece un elemento teniendo solo su número atómico, y a partir de su configuración electrónica y a la inversa respectivamente.
Y poder distinguir el bloque en que se encuentra dicho elemento en función del orbital que se encuentre su último electrón
N = bloque p pues, su último electrón se encuentra en el orbital p a este bloque pertenecen los grupos del 13 al 18 inclusive
c) Escribir la representación de Lewis para la molécula de NH3 e indicar cuál es la distribución espacial de los átomos de dicha molécula, explicándolo mediante el Modelo de repulsión del par electrónico del nivel de valencia.
El amoníaco, en el cual el nitrógeno tiene 4 pares de electrones de valencia, uno no enlazante y tres enlazantes, tendrá geometría de pirámide trigonal, a pesar de que los pares electrónicos se dispondrán de forma tetraédrica por ser 4. El RPECV , lo utilizamos Para predecir la geometría de las moléculas covalentes dado que los electrones son cargas negativas y se repelen entre sí, la geometría de la especie química considerada será aquella que permita minimizar las repulsiones entre los pares electrónicos que se hallan en torno al átomo central. Estos pares electrónicos pueden ser pares enlazantes o pares no enlazantes, colocándose lo más separados posible para que la repulsión entre ellos sea mínima, los pares no enlazantes causan mayores repulsiones a lo pares vecinos que los pares enlazantes, motivo por el cual el NH3, con pares libres en torno al átomo central, presentan ligeras variaciones en el ángulo de enlace esperado.
b) Calcular el volumen de amoníaco (en condiciones de P = 1atm y T = 20⁰C) que será necesario para preparar 126 g de HNO3 si el rendimiento de la reacción es del 85%.NH3 (g)+ 2o 2(g) →→HNO3 (ac) + H2O (l)
ES LARGO PERO YA ESTÁ CASI TODO HECHO. GRACIAS.
José Miguel
el 5/11/16Hola Yanet, tu duda es realmente confusa, la verdad es que podrías haber sido más específica y no colgar toooooodo el problema completo. Hubiese sido suficiente con la duda en concreto. Además, dices no saber cómo abordad el inciso d) pero yo no lo veo, supongo que te refieres al b) verdad? Es el último que has escrito y el que veo que no has resuelto.
Te explico, lo primero es comprobar que la reacción está ajustada, lo cual veo que está. Después es cuestión de pasar esos 126g de HNO3 a moles, para facilitar los cálculos, sabiendo que la masa molecular del ácido nítrico es 63g/mol, por lo que 126/63= 2 moles de HNO3 . Ahora, a través de la reacción vemos que para producir un mol de nítrico se necesita hacer reaccionar un mol de amoniaco, luego para obtener 2 moles de HNO3, se hacen reaccionar 2 moles de NH3 . Hasta aquí todo muy sencillo de deducir, peeeeero, nos dicen que la reacción tiene un rendimiento del 85%, y eso significa que no todo nuestro reactivo se convierte en producto, luego realmente deberemos usar una mayor cantidad de reactivo para obtener la cantidad deseada de producto, Si 2 moles es el 85% de la cantidad de reactivo utilizado, x, solo debemos calcular ese porcentaje a la inversa, o sea = 2 · 100/85 = 2,353 moles de NH3 se habrán utilizado. Ahora toca pasar esos moles a volumen mediante la ecuación PV=nRT introduciendo los valores que nos indican: 1 ata y 20ºC que equivalen a 293K. Procedemos= 1·V=2,353 · 0,082 · 293 de donde despejamos el volumen y obtenemos V= 56,53 litros de NH3.
Espero que con esto se resuelvan tus dudas, si tienes alguna más, por favor, especifica un poco más a la hora de plantearla.
Saludos.
-
Hola profe, podrías hacer un video explicativo sobre la teoría cuántica de plank? Estoy algo confundido...y en este ejercicio no tengo ni idea de como hacerlo:
El primer potencial de ionización del Cesio vale 374167 J/at-gr. Calcular: a)La longitud de onda, frecuencia y número de ondas de dicha radiación. c)La velocidad del electrón emitido cuando el átomo de Cs se le irradia con una radiación de longitud de onda 2500 Angstroms.
Datos: a)E1 =6,213 X 10-12 erg/at.; b) λ=3,2 x 10 -5cm; ν= 9,378 x 1014; ∇= 3,126 x 104cm-1; c) v=6,18 x 107cm/s
Gracias!!!
David
el 7/11/16Te sugiero los videos de fisica cuantica... Química cuántica
A partir de ahí, se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado, pero no olvidéis de adjuntarlo de forma LITERAL, para saber que os piden. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-) -
David
el 7/11/16Se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado, pero no olvidéis de adjuntarlo de forma LITERAL, para saber que os piden. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. Nos cuentas ¿ok? #nosvemosenclase ;-)
-
 Muchas gracias David por ayudarme, ahora tengo una pregunta en el ejercicio número 21
Muchas gracias David por ayudarme, ahora tengo una pregunta en el ejercicio número 21Esta sería la reacción balanceada
2NH3 + 3Cl2 >>>>>>>>> N2 + 6HCl
Tengo 3 litros de NH3 y 5 litros de Cl2 y me piden hallar los volúmenes de productos y reactantes al final de la reacción.
¿tengo que buscar cual es el reactivo limitante para N2 y 6HCl?
¿los volúmenes de productos (NH3 y Cl) que tendría al final de la reacción son los mismos que me dan para empezar (3 litros y 5 litros respectivamente)?
José Miguel
el 5/11/16Hola Jean Piere, para empezar te sugiero que antes de nada veas los siguientes vídeos: Estequiometría
Ahora te explico, esos volúmenes, bajo las mismas condiciones de P y T, te van a dar la misma proporción de moles para ambos reactivos, de modo que después de balancear la reacción como bien has hecho:
Yo voy a suponer que la reacción ocurre a condiciones normales de P y T, de modo que pasando a volumen los datos de la reacción (1 mol de cualquier gas en condiciones normales de P y T ocupa un volumen de 22,4L), observo que 44,8L de NH3 reaccionan con 67,2L de Cl2 para dar 22,4L de N2 y 134,4L de HCl.
Ahora debemos localizar el reactivo limitante: si 44,8L de amoniaco reaccionan con 67,2L de cloro, 3 litros (que nos da el problema) reaccionarán con x litros de cloro, despejando esa x nos da 4,5 litros, y el problema nos da 5 litros de cloro, luego este es el reactivo en exceso y el NH3 es el reactivo limitante. Pues a partir del limitante calculamos los producto de la reacción. Si 44,8L de amoniaco se gastan enteros para producir 22,4L de N2, entonces 3L de amoniaco darán: 3 · 22,4/44,8= 1,5L de N2.
Usamos el mismo reactivo para calcular los litros de HCl, en este caso, 44,8L de NH3 reaccionan para dar 134,4L de HCl, entonces 3L de amoniaco darán: 3 · 134,4/44,8= 9L de HCl.
El único reactivo en exceso es el cloro (Cl2), y com pudimos ver en uno de los primeros cálculo, 3L de amoniaco reaccionan con 4,5L de cloro, luego nos sobran 0,5L de cloro.
Piensa que todo esto se ha calculado suponiendo condiciones normales, pero pongas las condiciones que pongas, aun obteniendo cantidades distintas, la relación debe ser la misma, y podrías hacer la prueba. O sea, la relación me refiero a que por 3L de amoniaco se producen 1,5 de nitrógeno, la relación es 3:1,5. Lo mismo con el cloro, la relación es 3:9. Pues esas mismas proporciones deben darte pongas las condiciones que pongas.
Espero que lo hayas entendido y eso sea todo.
Saludos.
-
Buenos Dias, me podrían ayudar aclarando una inquietud.
No tengo claro como se realizan sales oxisales mixtas, podrían explicarme con unos ejemplos porfavor !
José Miguel
el 5/11/16Mírate el siguiente vídeo a ver si te aclara la duda:
Oxisales según IUPAC 2005 -
Buenas tardes.
Necesito ayuda con este ejercicio.
el enunciado dice asi: Averiguar la relación en volumen en que deben mezclarse dos disoluciones de permanganato de potasio 0,250M y 0,320M para preparar una disolución 0,306M, suponiendo que los volúmenes son aditivos.
Muchas gracias
José Miguel
el 5/11/16Hola Ylenia, te explico, con esas dos disoluciones debemos conseguir una final con una concentración de 0,306M, luego necesitamos proporciones distintas de cada una, las cuales representaremos con x e y de la siguiente manera: (un sistema de ecuaciones)
0,250x + 0,320y = 0,306
x + y= 1
Lo resolvemos mediante sustitución, por ejemplo despejando la x en la ecuación de abajo: x= 1 - y ; la sustituimos en la de arriba y procedemos:
0,250(1-y) + 0,320y= 0,306 que resuelta esta ecuación nos da y= 0,8. Sustituimos ese valor en la ecuación de abajo y obtenemos x=0,2. Pues esas son las cantidades a utilizar, un 20% de disolución 0,250M y un 80% de disolución 0,320M.
Saludos.
-
Buenos días, llevo varios días intentando resolver este problema de cinética química: La reacción A -> Productos es de primer orden en A. Inicialmente [A]=0.800 M y transcurridos 54min, [A] = 0,100M. a) ¿Para qué tiempo es [A]=0.025? b) ¿Cuál es la velocidad de reacción cuando [A]=0.025M? .
Agradecería enormemente que alguien me ayudara a resolver este problema.
Un saludo.
José Miguel
el 5/11/16Hola Ana, mírate los vídeo del tema: Cinética Química
-
¡Hola! Estoy en 1º de bachiller y aun no he tenido tiempo de ver todos los vídeos de química orgánica, me gustaría saber si hay vídeos que expliquen los hidrocarburos alicíclicos (cicloalcano y cicloalqueno) y los hidrocarburos aromáticos (benceno). Si no los hay, ¿me lo podeis explicar?
Graciaaas.