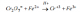-
H2S +K2Cr2O7 +H2SO4 --> Cr2(SO4)3 + S + H2O + K2SO4
No consigo llegar al balanceo final, si alguien pudiera decirmelo?
Muchas gracias
Antonio
el 4/6/16Si hacemos las dos ecuaciones y las equilibramos con iones o moléculas de agua tendremos:
H2S -> S +. 2H+. 2e-
Cr2O72- + 14 H+. + 6e- ->. 2 Cr3+. + 7 H2O
Ahora añadir los iones complementarios como SO4 2- los K+ y queda:
3 SH2 + Cr2O7K2 + 4 H2SO4 -> 3 S + K2SO4 + Cr2(SO4)3 +7 H2O
Método ion electrón -
Hola ayudenme con este ejercicio porfisss
No se como calcular el Ph que me piden en el apartado b)
8) Calcule:
a) El pH de una disolución 0,02 M de ácido nítrico y el de una disolución 0,05 M de NaOH (1 punto).
b) El pH que resulta al mezclar 75 mL de la disolución del ácido con 25 mL de la disolución de la base. Suponga los volúmenes aditivos (1 punto).
En el apartado a con los datos del acido y de la base he calculado el pH de cada especie
en el b con los datos que me daban en a he calculado los moles de cada especie, luego he sumado los volumenes y con los moles he obtenido la nueva molaridad, y me he quedado estancada ahi y no se como seguir para calcular el pH :((((((
jrv
el 2/6/16la molaridad de cada uno de los elementos sigue siendo la misma, por lo tanto, nos están dando la molaridad y el volumen para sacar los moles, por lo consiguiente, te están dando los moles que se añaden, después sumas los moles que has sacado del primer ejercicio a los moles que sacas de este segundo, de este modo sacas los moles de H+ y OH- , después de esto lo que haces es restar los moles de acido o base que tengas menos a los que mas tienes, así sacas el carácter de la reacción y lo mas importante, los moles que te quedan de H+ o OH- , finalmente aplicas el logaritmo y demás.
Yo lo hubiera hecho así si ve algo que no cuadra, por favor me corrigen, así aprendemos todos.
un saludo -
hola, pongo un ejercicio que no se sacar el W y el Q
Me dice lo siguiente
Un mol de gas ideal se halla en un estado de equilibrio inicial "A", (P=12atm y V=2L) y evoluciona hasta un estado de equilibrio final "C" (P=12atm y v=2L).
Pero pasa por un estado intermedio "B" (P=2atm y 2L) .
DATOS:
R=0.082atmLK^-1mol^-1
h=6.62607*10^-34
C=3*10^8
Capacidad calorífica molar de un gas ideal: si v=cte, Cv=3/2R; si P=cte, Cp=5/2R
me gustaría conocer mas o menos que tendria que buscar para hayar lo que busco
Muchas gracias

David
el 2/6/16Echales un vistazo.. Isoprocesos
El paso de A a B es una transformacion isocora (el volumen final y el inicial es el mismo)
El paso de B a C es tambien es una transformación isocora....
En cada caso plantea las ecuacuones corresopondientes..
Si pasas directo de A a C es una transformación isobarica (las presiones final e inicial serían iguales)
Se trata de que DESPUES DE IR A CLASE (ver los vídeos relacionados con vuestras dudas) enviéis dudas concretas, muy concretas. Y que nos enviéis también todo aquello que hayais conseguido hacer por vosotros mismos. Paso a paso, esté bien o mal. No solo el enunciado. De esa manera podremos saber vuestro nivel, en que podemos ayudaros, cuales son vuestros fallos.... Y el trabajo duro será el vuestro. #nosvemosenclase Nos cuentas ¿ok?
-
Hola! En estos dos ejercicios no piden Ley de Hess, pero viendo una posible resolución del 4) usan la ley de hess para hallar la entalpía de la combustión. Mi duda es si estaría igual de bien hacerlo con la fórmula del incremento de moles por entalpia de los productos menos incremento moles por la entalpia de cada reactivo. He probado y sale el mismo resultado, pero ¿quizás por ser una combustión este más indicado hacerlo por Hess? . ¿A caso la ley se aplica solo cuando falten datos o cuando te lo pidan explícitamente?
Muchas gracias

David Moldes
el 1/6/16Cuidado. Sólo puedes aplicar la fórmula que dices cuando tienes entalpías de formación, y no otro tipo. En muchos exámenes te dan diferentes entalpías de reacción (de combustión, de hidrogenización...) y la gente lo hace por la fórmula pero está mal, pues esas no son entalpías de formación y hay que hacerlo por ley de Hess.
Te recomiendo que siempre lo hagas por Ley de Hess, pues es un método que no falla y que te vale tanto si te dan o no entalpías de formación. En tu caso, si tenías de formación, pues la fórmula te debe dar el mismo resultado. -
Holaa necesito ayuda con el método de ion electron. Lo entiendo bien y lo se hacer, pero yo le añadiría 3 electrones a la semireaccion de reducción y en la resolución le añaden 6.
Muchas gracias!!!
-
Hola, ¿alguien podría ayudarme con este ejercicio?
Me dan la reacción: HCl + K2Cr2O7 --> Cl2 + CrCl3 + KCl + H2O. (Todos en estado acuoso y el agua líquida).
Me piden Las semirreacción de oxidación y reducción y ajustar la reacción en forma molecular.
He intentado hacerla antes de ver el vídeo de la resolución y la reacción global no me da lo mismo y en el vídeo no explica casi... :(
Os agradecería que me lo explicarais, ¡muchas gracias por adelantado!

José Miguel
el 1/6/16Hola Alba! Lo primero que deberías hacer es ajustar la reacción: 14HCl(ac) + K2Cr2O7(ac) → 3Cl2(g) + 2CrCl3 + 2KCl + 7H2O
Así es como me queda a mi...
La semirreacción de oxidación la protagoniza el cloro que pasa de ion cloruro a cloro molecular.
La semirreacción de reducción, el cromo que pasa de un estado de oxidación +6 en los reactivos, a +3 en los productos.
Te paso una imagen y me cuentas si te ha servido. Además, te dejo un enlace a un vídeo que también te servirá:
http://www.quimitube.com/videos/prediccion-reaccion-redox-dicromato-cloruro-yoduro
Saludos! -
hola! Estoy en el tema de estequiometria, me podeis decir lo que debo saber para que me sea mas facil resolver ejercicios de disoluciones y de reacciones de neutralizacion ? gracias!!