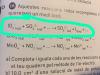-
Buenas tardes,
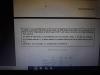
En ejercicio de neutralización me dicen que se va a hacer una reacción con ácido fuerte HCl (aq) y base fuerte NaOH (aq) en un calorímetro. Me dan como datos 40mL NaOH de 2M 98% de riqueza y 2,13 g/mL de densidad; por otro lado 40mL HCl de 2M de 37% de riqueza y 1,19g/mL de densidad. Me piden calcular los moles y el volumen neutralizado de HCl y NaOH determinando el reactivo limitante y los moles de NaCl conseguidos después de la neutralización.
A ver si alguien me ayuda ya que es el único ejercicio distinto con el que me he encontrado.


Breaking Vlad
el 29/3/18Hola Aitor,
Ese enunciado no está bien. Por un lado te habla de concentraciones molares, y por otro lado te da % y densidades. No es coherente darte ambos datos.
Si te da molaridades, obvia todos los porcentajes y densidades y lleva a cabo todos los cálculos usando la molaridad exclusivamente.
Un saludo,
Breaking Vlad
-
hola necesito ayuda con este problema de 3ero de la eso
La densidad de la leche es de 1'03 g/ml. Y tiene 2'9 g de proteinas disueltas en 100ml . Explica la concentracion de las proteinas A- en g/L, B- en porcentaje de masa (m%)
-
¿Como se deducen este tipos de ejercicios?
Dado el equilibrio:
CO (g) + H 2 O (g) <==> CO 2 (g) + H 2 (g)
Elija una:
Si en un recipiente se introducen las cantidades de sustancias indicadas, en cuáles de estos casos el sistema no evolucionará hasta un estado de equilibrio?
a. 1 mol H 2 O y 1 mol H 2
b. 1 mol CO 2 y 1 mol H 2
c. 1 mol CO, 1 mol CO 2 y 1 mol H 2
d. 1 mol H 2 O y 1 mol CO 2


Breaking Vlad
el 29/3/18Hola Juan,
se hacen aplicando el principio de le chatelier: https://youtu.be/QUxolGq6g3w
Espero que te sirva de ayuda el vídeo,
un saludo,
Breaking Vlad


Juan
el 29/3/18Hola Breaking Vlad,
Es precisamente lo que he pensado pero, si no lo estoy haciendo mal, tanto a) como d) no experimentan variaciones para regresar a un estado de equilibrio, ya que en los dos casos tanto el numero de reactivos como de productos se aumentan por igual.
El ejercicio da a entender que solo una opción es correcta. ¿Esta mal planteando el ejercicio entonces? -
Buenas, ¿me podrían ayudar con el b) de este ejercicio?, pues aunque tengo la solución del mismo, no comprendo por qué para el Xe utiliza el 75% pero para el F2 utiliza el 60% para calcular los moles de Fe2 al 75%.
Gracias.

Teresa
el 28/3/18Hola, supongo que el problema te dirá que partes de 0,4 moles de Xe y n moles de F2. Y además te dirá que reacciona el 75% del Xe. Por tanto sabes que reacciona el 75% de 0,4 es decir 0,3 y por tanto te quedan 0,1 moles de Xe. Por estequiometria, reacciona el doble de F2 que de Xe, por tanto si de Xe han reaccionado 0,3 moles, de F2 deben haber reaccionado el doble, 0,6 y por tanto en el equilibrio quedarán los 0,1 de Xe(0,4 iniciales-0,3 que han reaccionado) y de F2 quedarán n-0,6 (no es el 60% es el doble de lo que reacciona de Xe).
-
Hola.
El apartado a) de este ejercicio, mi libro lo resuelve como está en la imagen; calcula la energía empleada para disociar 4 enlaces del tipo TiCl y divide entre 4 para ver la energía que requiere cada enlace.
Mi pregunta es, ¿por qué calcula con 4? ¿Por qué no puede calcular por ejemplo con 3, con 2 o con 1? Además con 1 el resultado ya está directamente en los datos del ejercicio.
Muchas gracias.
Un saludo.


Breaking Vlad
el 27/3/18Hola Sergio,
porque te pregunta por la energía PROMEDIO. Fíjate arriba que tienes 4 entalpías de enlace para cada uno de los cloros, y todas las entalpías son diferentes.
Si cogieras solo una, no podrías hacer una media, te daría un valor único, y es un promedio incorrecto. Lo correcto es calcular la entalpía de disociación total y hallar el valor medio.
Un saludo,
Breaking Vlad
-

Camila Astrada
el 26/3/18Hola Julian, cuando hay dos cuerpos a diferentes temperaturas (uno con mayor T que el otro) lo que va a ocurrir es que el calor va a fluir desde el cuerpo mas "caliente" al mas "frio" hasta encontrar una temperatura de equilibrio. Por lo tanto si uno de los liquidos está a 10°C y otro a 70°C, la T de equilibrio va a ser un valor entre 10 y 70 °C. Ahora para calcular exactamente cual será esa Teq, necesitas que te den como dato que es cada cosa (no es lo mismo tener agua que tener un ladrillo) esto depende de un coeficiente llamado Calor especifico.
-

Guillem De La Calle Vicente
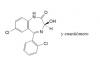
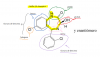
el 26/3/18Te tienes que fijar en cada carbono. Si hay alguno que no este unido solo a carbonos probablemente hay un grupo funcional.
En tu ejemplo, el O (con doble enlace) es una cetona o carbonilo, el OH-H es un carboxilo. El HN puede ser un imino (no estoy seguro). Y los cloros y los nitrogenos supongo que seran grupos funcionales, pero no me suenan.
Saludos.
-

Teresa
el 27/3/18Este es igual que el anterior, en este te dan la longitud de onda de la radiación incidente, aplicando νλ=c obtienes la frecuencia y entonces aplicando E=hν tienes la energía de la radiación incidente, tienes también el trabajo de extracción, que es hνo y aplicando la ecuación del problema anterior despejas qV que es la energía cinética que se transfiere al electrón. y el apartado b igual también, una vez tienes la Ec despejas v y aplicas λ=h/p Ten cuidado con las unidades.
-

Teresa
el 27/3/18El efecto fotoeléctrico se produce cuando una radiación de energía adecuada incide sobre la superficie del metal arrancando electrones. Energía adecuada, porque cada metal tienen una energía mínima para arrancar sus electrones, por lo tanto si la radiación es igual a esa energía característica de cada metal únicamente se arrancará el electrón de la superficie de dicho metal, si la energía de la radiación es mayor a esa energía mínima, se arrancará el electrón y con la energía sobrante se cederá al electrón en forma de energía cinética es decir: h ν= qV + h ν0
De la energía total de la radiación h ν0 es la energía necesaria para arrancar al electrón y qV es la parte que se transfiere al electrón como energía cinética.
Para el apartado a. dispones del valor de la radiación total hv y del valor de la energía cinética qV de ahí despejas h ν0
Una vez hallado ese termino, y conociendo h que es la constante de Planck, se despeja el valor de la frecuencia umbral o mínima que te piden, y la longitud de onda aplicando νλ=c y despejas.
El apartado b. la λ de De Broglie asociada al electrón λ=h/p p es la cantidad de movimiento que la puedes calcular como v.m y la v la calculas, pues conoces la energía cinética del electrón que te lo dan como dato.